Пуллороз у индюшат лечение: Как лечить Пуллороз у индюшат?
Болезни индюков
Возбудитель и пути заражения
Паразит-возбудитель – одноклеточный микроорганизм Histomonas (Гистомонда). Активно размножается размножается путем двойного деления. Проходит 2 стадии развития: жгутиковую и амебовидную.
Возбудитель попадает в организм индюшки алиментарным путем (через органы пищеварения) при заглатывании зараженного корма, жидкостей. Паразит бурно развивается в кишечнике, особенно в слепых отростках. Гистомонда выделяет особые ферменты, которые запускают переваривание тканей. В месте скопления микроорганизмов появляются глубокие поражения стенок – омертвения и некрозы. Вместе с кровотоком паразит достигает печени, здесь мельчащие организмы поражают паренхиму, появляются концентрированные очаги.
ВНИМАНИЕ! Переносчиками гистомоноза выступают мухи и блохи, дождевые черви, комары – любые насекомые, которых поедают индюшки. Пик заболеваемости приходится на лето, так как именно в этот время особи активно поедают различных насекомых.
Основные причины распространения инфекции.
- Антисанитарные условия содержания: грязь, общие поилки и кормушки, отсутствие вентиляционной системы.
- Некачественные корма: загрязненное зерно, немытые корнеплоды.
- Нехватка места и теснота при высокой скученности поголовья.
- Смешивание разных видов птиц в помещении.
- Совместное содержание индюшек разного возраста.
Гистомонозу подвержены индейки любого возраста, но самый высокий риск заражения у особей через 15-90 суток после рождения. Распространяют болезнь чаще всего взрослые больные особи, так как в их помете обычно много гистомонад.
Кокцидиоз у индюков: симптомы и лечение
Для взрослых индюков кокцидиоз не представляет серьезной опасности, но у молодняка может быстро спровоцировать смерть. Заражению поголовья способствует использование инфицированной воды, а быстрое распространение болезни объясняется тем, что у взрослых особей болезнь практически никак не проявляется, а остальные птицы могут заразиться через кормушки и поилки (рисунок 6).
Рисунок 6. Симптомы кокцидиоза у индеек
У зараженных птиц полностью исчезает аппетит, они становятся вялыми и сонливыми, а птенцы могут беспричинно пищать. Кроме того, птицы много пьют, и у них появляется понос с примесью крови.
Чтобы устранить болезнь, нужно изолировать зараженных особей и обеспечить проветривание птичника. Возбудитель болезни особенно активно развивается в теплой и влажной среде, поэтому качественная приточно-вытяжная вентиляция – обязательно условие содержания индеек. Для лечения используют антибиотики в комплексе с народными средствами и усиленным витаминизированным кормлением.
Профилактические меры
Намного проще и легче предотвратить заболевание, чем потом его лечить. Профилактические меры состоят из комплекса мероприятий, направленных на обеспечение комфортных условий обитания птицы, качественного, полноценного питания и своевременной очистки птичника.
Соблюдение температурного режима
Как известно, для любого респираторного заболевания наиболее благоприятной является сырая и влажная среда, поэтому в помещении, где обитают индюки, следует реализовать необходимый температурный режим:
- в первую неделю жизни индюшат температуру в помещении поддерживают на уровне +32…+34 °С;
- начиная с 8-го по 14-й день, температуру постепенно снижают в пределах +28…+32 °С;
- с 15-го по 21-й день температурные показатели устанавливают на отметке +26…+28 °С;
- с 22-го дня и дальше температуру снижают до +18 °С.

Читайте подробнее как лечить понос у индюков.
Условия содержания
Не менее важным в профилактике синусита считаются условия содержания, к которым выдвигают ряд требований:
- на 1 кв. м должно располагаться не более 10 особей 8-недельного возраста, 5 особей — 16-недельного и 3 особи старшего возраста;
- категорически запрещается содержание индеек с птицами другого вида;
- ежедневная замена подстилочного материала в птичнике. В качестве подстилки отлично подойдёт солома, опилки, торф, кукурузные стебли;
- хорошая вентиляция. Застойный влажный воздух в помещении негативно сказывается на здоровье птиц, способствует развитию различных инфекционных недугов;
- отсутствие сквозняков. Часто именно сквозняки становятся причиной возникновения простудных, респираторных болезней, в том числе синуситов.
Рацион питания
Качественное, сбалансированное по витаминам и минералам питание позволит укрепить здоровье индеек, повысить сопротивляемость организма к внешним пагубным факторам, улучшить физическое здоровье. В рационе обязательно должны присутствовать корма, богатые витаминами А, В, Е, С. Их могут обеспечить различные зелёные травы, свежие овощи, зелень. В меню обязательно должны присутствовать зерновые — овёс, пшеница, кукуруза, а также корнеплоды, бобовые. Хорошими стимуляторами иммунитета для птицы считаются чеснок, зелёный лук, яблочный уксус, которые добавляются в воду.
В рационе обязательно должны присутствовать корма, богатые витаминами А, В, Е, С. Их могут обеспечить различные зелёные травы, свежие овощи, зелень. В меню обязательно должны присутствовать зерновые — овёс, пшеница, кукуруза, а также корнеплоды, бобовые. Хорошими стимуляторами иммунитета для птицы считаются чеснок, зелёный лук, яблочный уксус, которые добавляются в воду.
Узнайте как несутся индюшки.
Рекомендуется обеспечить птиц минеральной подкормкой, в качестве которой подойдут мелкие ракушки, мел, известняк. Регулярно следует давать индюкам готовые витаминно-минеральные комплексы, которые позволяют устранить дефицит активно-биологических компонентов в организме, улучшают пищеварение, укрепляют иммунитет. Обязательно в птичнике всегда в поилках должна быть чистая, свежая вода, чтобы птицы могли в любое время утолить жажду.
Уборка и дезинфекция
Залогом хорошего здоровья индюков также является чистота помещения. Если в хозяйстве зафиксирован случай возникновения инфекционного синусита, следует незамедлительно отделить заболевшую особь от других, а в птичнике провести дезинфекцию:
- помещение хорошенько вымывают простой тёплой водой;
- три дня просушивают птичник;
- далее проводят обработку стен, потолка, пола и всего оборудования дезинфицирующими средствами: раствором марганцовки или гашёной извести.

Вам также будет интересно узнать чем полезно и вредно мясо индейки.
К сожалению, вакцины от такой серьёзной болезни, как инфекционный синусит, на данный момент не существует, поэтому заводчик, который желает вывести здоровых и крепких индеек, должен обязательно знать первые характерные симптомы недуга, эффективные методы его лечения и не забывать, что наиболее действенным методом борьбы с болезнью является своевременная, качественно выполненная профилактика.
Всё о болезнях индюшат
Индюшата более подвержены различным заболеваниям, нежели взрослые птицы, поскольку они весьма чувствительны к режиму питания и температуре содержания.
Основные недуги индюшат, их признаки и лечение будут подробно описаны ниже. Но в первую очередь стоит определиться, по каким симптомам можно распознать зараженную птицу.
Симптомы
Болезни индюшат сопровождаются характерными признаками, которые помогают точно поставить диагноз и своевременно начать лечение. Поскольку для каждого заболевания существует свой список симптомов, ниже мы подробно рассмотрим основные патологии птиц.
Поскольку для каждого заболевания существует свой список симптомов, ниже мы подробно рассмотрим основные патологии птиц.
Однако, вне зависимости от типа недуга, зараженные индюшата теряют аппетит, выглядят вялыми, часто падают на ноги или страдают от судорог. При обнаружении любых отклонений в поведении птиц, нужно сразу же провести диагностику.
Виды болезней
Наиболее распространенными болезнями молодняка являются (рисунок 1).
- Холера (пастереллез) представляет собой острую инфекцию, которая часто приводит к массовой гибели поголовья. Для того, чтобы не допустить развития патологии, необходимо регулярно проводить дезинфекцию, закупать молодняк только в проверенных хозяйствах и строго соблюдать санитарные нормы содержания.
- Паратиф поражает индюшат в возрасте до 30 дней после вылупливания. Для профилактики с первых дней индюшатам дают фуразолидон или биомицин.
- Белый понос (пуллороз) возникает в том случае, если молодняк был получен от зараженной особи или содержался вместе со взрослыми индейками.
 Условно здоровых лечат, а больных отправляют на убой.
Условно здоровых лечат, а больных отправляют на убой. - Инфекционный синусит – заразное заболевание, в результате которого воспаляются слизистые подглазных полостей с последующим накоплением в них гноя. Провоцирующим фактором служит высокая плотность посадки и недостаток витаминов А и Д в рационе.
- Гистомоноз – болезнь печени и слепой кишки, которая поражает птиц в возрасте от двух недель до трех месяцев. Для лечения используется фуразолидон.
- Трихомоноз также является заболеванием печени и кишечника, для лечения которого используют препарат трихопол.
- У индюшат, пораженных кокцидозом, появляется жидкий стул с вкраплениями крови, а для борьбы с заболеванием используют кокцидиовит и ампролиум.
- Аспергиллез представляет собой грибковое поражение дыхательных путей. Действенного средства лечения патологии нет, поэтому единственным методом борьбы является профилактики: скармливание только доброкачественных кормов и содержание в сухом, теплом и чистом помещении.

Рисунок 1. Основные болезни индюшат: 1 — пастереллез, 2 — синусит, 3 — пуллороз, 4 — кокцидиоз
Из видео вы узнаете, какие профилактические средства являются самыми эффективными для предотвращения болезней индюшат.
Причины заболеваний
Индюшата считаются очень чувствительными к условиям содержания, кормления и температуре окружающей среды. При этом взрослые птицы обладают достаточно высокой устойчивостью к заболеваниям.
Спровоцировать заражение индюшат могут несвежие корма или загрязненная питьевая вода. Также у птенцов часто бывают простуды, которые вызывает слишком низкая температура содержания. Грязь и помет в птичнике могут вызвать заражение и воспаление органов пищеварения, что неизменно провоцирует понос и даже может стать причиной гибели всего поголовья.
Симптомы гистомоноза
Длительность инкубационного периода составляет 1-3 недели. Острая форма заболевания проявляется следующими симптомами:
- у цыплят снижается активность, отмечается опускание крыльев;
- снижается или вовсе пропадает аппетит;
- на 2-4 сутки наблюдается диарея, фекалии имеют буро-зеленый цвет и резкий неприятный запах;
- кожа на голове приобретает темный цвет – у взрослых птиц темно-синий, у молодняка черный;
- температура тела понижается примерно на 1-2°С.
Симптомы гистомоноза у птицы
Больные птицы сбиваются в кучки, закрывают глаза, прячут под крыльями головы. На 5-7 день у молодняка уже ярко выражено истощение, цыплята очень мало передвигаются и ходят пошатываясь. Длится болезнь от 1 до 3 недель, после чего птицы гибнут или выздоравливают, оставаясь переносчиком инфекции. Самая высокая смертность наблюдается у индюшат, а вот молодняк кур переносит гистомоноз легче, хотя падеж все же случается.
Выявленное на ранних стадиях заболевание можно вылечить или вовремя остановить его развитие среди поголовья индеек
Симптомы хронической формы:
- снижается аппетит;
- оперение становится тусклым;
- отмечается угнетенное состояние и слабость.
Продолжительность болезни может составлять несколько месяцев. Чаще всего хроническая форма проявляется в середине лета, когда птицы активно добывают из земли червей, поедают насекомых. Но если условия содержания совсем не соответствуют санитарным нормам, болезнь может появиться в любое время года. Распространяется инфекция быстрыми темпами, поэтому всего за пару дней может заразиться все поголовье.
Гистомоноз может быстро распространиться среди всей домашней птицы
Описание болезней
Организм молодых индюшат крепчает с возрастом. Малейший сквозняк или низкая температура могут спровоцировать у них различные болезни не только у молодняка, но и взрослой птицы. Перечень заболеваний является общим для молодых индюшат и взрослых индюков.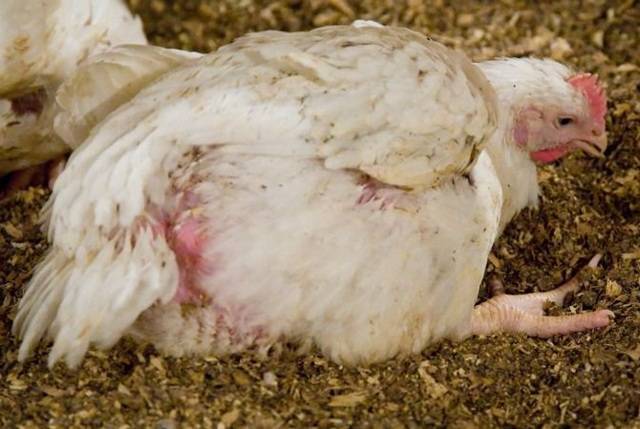
Болезни индюков
Привести к падежу птицы могут любые виды болезней. Некоторые из них несут опасность для здоровья и жизни человека. На эффективность их лечения оказывает влияние скорость выявления больных особей и точное определение вида недуга. Среди самых распространённых заразных болезней:
- Аризоноз. Возбудителем болезни являются анаэробные бактерии. Её инкубационный период — 3-7 дней. Протекает она в острой форме токсикоинфекции. Индейки становятся вялыми, длительное время сидят нахохлившись. Болезнь сопровождается поносом, судорогами, параличом ног. У идеек происходит искривления шеи, глаза покрываются гноем, который склеивает птице веки. Последствием болезни становится слепота. Летальный исход болезни в первые недели жизни составляют 15-60%.
- Гистомоноз. Возбудителем болезни являются микроорганизмы, входящие в отряд жгутиковых. Вспышки болезни возникают в жаркую погоду. Наибольшую опасность болезнь предоставляет для индюшат в возрасте от 2-х до 3-х месяцев.
 Инкубационный период болезни 1-4 недели. Она поражает желудочно-кишечный тракт. Болезнь сопровождается поносом, потерей аппетитом, вялостью. У индеек обвисают крылья. Падеж птицы наступает от 1 до 3 недель.
Инкубационный период болезни 1-4 недели. Она поражает желудочно-кишечный тракт. Болезнь сопровождается поносом, потерей аппетитом, вялостью. У индеек обвисают крылья. Падеж птицы наступает от 1 до 3 недель. - Инфекционный синусит. Болезнь вызывается бактериями, которые поражают верхние дыхательные пути. У индеек снижается аппетит, затрудняется дыхание. В период болезни птицы практически не набирают вес их рост прекращается. В большинстве случаев заболеваний синуситом молодые индюшата погибают. Мясо и яйца больной птицы есть нельзя.
- Кокцидиоз. Возбудителем болезни являются одноклеточные паразиты. Они действуют избирательно. Индюки не могут заразиться этой болезнью от кур или гусей. Признаками болезни являются понос и геморрагическое воспаление. При неправильном лечении болезни падёж птицы может составить до 50%.
- Паратиф. Возбудителями болезни являются бактерии. Она свойственна индюшатам в возрасте от 3 до 20 дней. Падёж птицы составляет от этого заболевания 70-80%.
 Заболевание характеризуется белым поносом, потерей аппетита и судорогами.
Заболевание характеризуется белым поносом, потерей аппетита и судорогами. - Туберкулез. Вызывается бактериями, которые попадают в организм индюков по воздуху или с кормами. Болезнь может принимать хроническую форму. Инкубационный период составляет от 1 до 10 месяцев. Характерные признаки болезни — потеря веса, слабость, опухание суставов.
- Оспа. Возбудитель болезни РНК вирус. Явными признаками болезни являются жёлтые пятна на голове и коже индеек. Чаще всего болезнь поражает молодняк. Она поражает яйцевод. Это становится причиной того, что индюшки не могут нести яйца.
Самые распространённые незаразные болезни индеек
| Наименование болезни | Причины и последствия | Признаки |
| Твердый зоб | Неправильное кормление, недостаток воды. Смертность 100%. | У птицы наблюдается отвисший зоб. |
| Авитаминозы | Возникает из-за недостатка витаминов А, Е и D | Индюшонок, страдающий авитоминозом, теряет оперение и страдает рахитом. У него наблюдается слезотечение и понос У него наблюдается слезотечение и понос |
| Извращённый аппетит | Неполноценное кормление | Индейки расклёвывают всё подряд, включая свою тушку. |
Опасные для здоровья и жизни человека болезни индеек
Некоторые болезни индеек могут передаваться человеку при употреблении их мяса и яиц, а также при контакте с заражённой птицей и уборке помещения для её содержания . Наиболее опасные из них: орнитоз, сальмонеллез, грипп и пастереллез
При контакте с больной птицей человек должен соблюдать меры предосторожности защищая свои дыхательные пути и соблюдая меры гигиены. При первых признаках заболеваний необходимо сразу же обращаться к врачам-инфекционистам
Мясо и яйца птиц, заражённых инфекционными заболеваниями нельзя.
Лечение инфекционных заболеваний индеек в домашних условиях
| Наименование болезни | Способ лечения |
| Аризоноз | Индейкам дают антибиотики и химиопрепараты. |
| Гистомоноз | В течение 9-10 дней индюшатам дают метронидазол. |
| Инфекционный синусит | Для лечения болезни используют вакцину Бактерин MG |
| Кокцидиоз | Болезнь лечат такими препаратами, как Байкокс, Соликокс, Диакокс и другие. |
| Паратиф | Для лечения болезни используется противопаратифозную сыворотку. |
| Туберкулез | Больную птицу сжигают, а птичник больше не используют |
| Оспа | Лечение заключается в обработке оспинок йодом. В корм птицы добавляют клевер, листья люцерны, крапиву. |
Препараты индейкам дают вместе с кормом или питьём. Вакцины, чаще всего, добавляют в зерно в количестве 400 грамм на 1 тонну.
Лечение
Для борьбы с гистомонозом обычно назначают препараты из группы имидазола – это Тинидазол, Нитазол, Метронидазол (Трихопол) и аналоги. Дозировки и пропорции различны.
- Митронидазол – 5 г на 10 кг корма, продолжительность – 9-10 суток.

- Авиментронид – 3 г на 1 л питьевой воды либо 15 г на 2 кг корма.
- Энтеросептол для индивидуального скармливания – по 30 мг на 1 кг живого веса индейки. Продолжать 10-15 суток. В тяжелой форме допустимую дозировку увеличивают до 40 мг.
- Эмгал – по 1 г на голову утром и вечером. Повторять 5-7 дней.
- Осарол – 0,15 г на 1 кг корма. Минимальный курс – неделя.
- Фуразолидон – 4 г лекарства на 10 кг. Курс лечения – 2 недели.
Обычно таблетки измельчают и подмешивают в ежесуточный корм. На следующий день готовят свежую порцию «лечебной» смеси. Другой вариант – растворение в воде и закапывание в клюв при помощи пипетки или шприца без иглы. Точные наименования лекарств и рекомендации по приему можно получить у ветеринара.
Инфекции у молодняка
Неокрепший организм птенцов реагирует на заболевания острее взрослых. Особенно, если речь идет об инфекциях – зачастую существует риск потери целого молодого поголовья в случае несвоевременного нахождения симптоматики.
Гемофилез
Инфекционный вид насморка, который легко передается от одного птенца к другому при контакте с пораженной особью, пищей, водой или инструментами, которыми вы работаете с животными. Особенный риск заболевания существует у индюшат до достижения пятимесячного возраста.
Вирус гемофилеза
Типичное проявление гемофилеза:
- воспаление слизистых носоглотки и глазной области;
- выделения в виде слез и соплей;
- хрипы в груди, одышка;
- отсутствие аппетита, следствие которого – прекращение роста.
Характерный признак на поздней стадии развития недуга – из-за воспаления подглазных пазух голова птицы становится похожей на совиную.
Методов лечения такого насморка не существует – больных придется забить. Чтобы не допустить эпидемию среди поголовья, помещение дезинфицируют формальдегидом, растворяя его в размере 2% в воде, с добавками в виде едкого натра – 2%, свежегашеной извести – 20%. Всю смесь нужно довести до температуры в 70-80 градусов по Цельсию. Здоровых же птенцов подвергают ингаляциям с йодом и добавлением хлор-скипидара.
Здоровых же птенцов подвергают ингаляциям с йодом и добавлением хлор-скипидара.
Гистомоноз
Чаще всего гистомоноз возникает, если содержать индюков в недостаточно хорошо продезинфицированных помещениях. Особенно, если вы держите их в одном птичнике с курами, утками, гусями. Либо же, если строение им досталось после этих видов сельскохозяйственных птиц.
Посинение головы
Особенности:
- характерный стул оранжево-желтого оттенка;
- пассивное поведение, птица все время стоит одна в углу с закрытыми глазами;
- аппетит отсутствует;
- кожные покровы приобретают сине-черный оттенок вследствие поражения печени и кишечной системы.
Опытные фермеры советуют следующие медикаменты для устранения проблемы:
- трихопол;
- фуразолиндон;
- метронидазол;
- оксарсол.
Помимо общего лечения необходима обязательная дезинфекция всех мест пребывания птицы. Помните, что в особой группе риска – птенцы в возрасте от 3 до 21 недели.
Пуллороз
Трехнедельные индюшата подвержены еще одной серьезной инфекции, которой можно заразиться через контакт с уже пострадавшими или через кормушки, которыми они пользуются.
Для пуллороза характерен жидкий стул белого цвета с клочками пены и неприятным запахом, который склеивает перья у клоаки. Птенцы хохлятся, тяжело дышат и издают слабый писк. В 70% случаев дело заканчивается детальным исходом – у ослабших птиц подкашиваются ноги, начинаются судороги, после которых они дохнут.
Подкошенные лапы
Помоч
Какие болезни определяют по внутренностям индюков. Какие бывают болезни у индюшат и как их лечить? Виды заболеваний домашних птиц.
Болезни индюшат и индюков представляют большую опасность, так как без соответствующего лечения могут вызвать гибель молодняка и снижение продуктивности взрослых особей. Чтобы правильно провести лечение, необходимо точно знать, какими симптомами сопровождается та или иная болезнь.
Описание самых популярных заболеваний взрослых индюков и маленьких индюшат с фото и схемами лечения вы найдете в этой статье.
Другие птицы, грызуны и грязная одежда могут также действовать как вектор, чтобы распространить болезнь. Высокий уровень гигиены необходим, чтобы избежать заболеваний черной головы, включая использование твердых полов с чистыми постельными принадлежностями сверху, регулярное удаление фекалий и грязных постельных принадлежностей, ежедневную очистку воды и кормов для кормления, контроль грызунов, ботинок для мойки обработчиков между ограждениями, вхождение в карантин животных собственность и правописание загонов, ручек и ограждений каждый второй цикл птиц.
Болезни индюшат, их признаки и лечение
Индюшата более подвержены различным заболеваниям, нежели взрослые птицы, поскольку они весьма чувствительны к режиму питания и температуре содержания.
Основные болезни индюшат, их признаки и лечение будут подробно описаны ниже. Но в первую очередь стоит определиться, по каким симптомам можно распознать больную птицу.
Молодым птицам также следует кормить лекарственное корм молодым, чтобы предотвратить заболевание. У индейцев часто развиваются инфекционные заболевания суставов, которые сидят на скакательных суставах в течение большого периода дня. Это может быть потому, что они имеют избыточный вес или потому, что у них боль в суставах или артрит. Киль или грудная кость у индюков также являются областью, которая подвержена этим типам язв. Контакт и давление с земли обусловливают образование струпьев или язв, и они могут превратиться в раны, через которые могут проникать бактерии.
Симптомы
Болезни индюшат сопровожда
описание заболеваний и методы лечения
При разведении индюков заводчик рано или поздно сталкивается с болезнями молодняка. В малом возрасте птицы подвержены огромному количеству заболеваний из-за слабой иммунной системы. Если вовремя их не лечить и не прививать, при первой же инфекционной болезни может вымереть все поголовье индюшек на подворье. Болезни индюшат, их симптомы, лечение и профилактика будут рассмотрены в ниже статье.
Инфекционные болезни индюшат и лечение
Инфекционные болезни очень опасны, так как могут привести к заражению всех птиц и массовому вымиранию. Не все перечисленные ниже болезни индюшат лечатся, но все можно предотвратить рядом профилактических мер.
Инфекционные болезни индюшат
- Пуллороз – белый бациллярный понос распространяется через личный контакт с больной особью, поилки, кормушки. Смертность – 70%. Наиболее подвержены ему индюшата до 20 дней. Симптомы: тяжелое дыхание, постоянный писк, постоянно закрытые глаза, белый, пенистый помет с неприятным, сильным запахом, пушок вокруг клоаки склеивается от жидкого стула. Лечат индюшат левомицетином, сульфадимезином, тетрациклином, фурацилином, фуразолидоном. Для профилактики молодняк поят витамином A, часто убирают клетки, отсаживают от взрослых индюков.
- Паратиф – болезнь индюшат, поражающая птенцов от 3 до 30 дней. Смертность – 80%. Симптомы: понос, малоподвижность, сонность, опущенные крылья, шаткая походка, слезотечение, склеивание век, жажда, плохой аппетит. Лечат недуг мепатаром, тримеразином, лаутецином. А для профилактики дают биомицин и фуразолидон на протяжении первых 10 дней жизни индюшат.
- Инфекционный синусит поражает молодняк от месяца и старше. Возникает при плохих условиях содержания (недостатке витаминов, холоде, сырости). Симптомы: воспаление слизистых в форме опухоли, где накапливается гной. Лечат болезнь водорастворимым тиланом, фуразолидоном, окситетрациклином, стрептомицином. Меры профилактики – чистота в индюшатнике и брудере, отсутствие сквозняков, холода, обеспечение птенцов витаминами A и D.
- Гистомоноз – черная голова. Это частая болезнь индюшат возрастом до 3 месяцев. Заболевание провоцирует воспаление слепой кишки и печени. Заболевшие особи почти не едят, а просто стоят сгорбившись. Черед 2 дня у них появляется понос, чернеет голова и ноги (из-за неправильного кровообращения). Лечение заключается в применении фуразолидона и метронидазола. Причем дают его и здоровым птицам, чтобы не заразились.
- Гемофилез или заразный насморк чаще всего наблюдается у особей, которым не исполнилось 4 месяца. Болезнь очень заразная, передается через грязный инвентарь, кормушки, поилки и, разумеется, больных птиц. Проявляется в виде воспаленных глаз, гортани, носовой полости. Из носовых отверстий выделяется жидкость, может иметься отдышка, хрипы, слезотечение, слабый аппетит. Болезнь эта не лечится, поэтому всех больных особей нужно уничтожать. Но можно проводить профилактику ингаляциями паров йода и хлор-скипидара.
Каким неинфекционным болезням подвержены индюшата?
Ознакомьтесь также с этими статьями
Незаразные болезни индюшат не так опасны, как заразные, но чаще встречаются.
- Энтерит поражает индюшат в возрасте от 6 до 12 недель. По сути, это воспаление слизистых оболочек кишечника. Причиной всегда является плохой корм, поэтому профилактика заключается в том, чтобы давать индюшатам только качественное зерно и мешанки. Симптомы: потеря аппетита, расстройство желудка. Лечение весьма простое – нужно обеспечить молодняк хорошим кормом, и птички сами поправятся.
- Гиповитаминоз наступает вследствие нехватки витаминов в организме индюшат. Симптомы: воспаление глаз, выделения из носа, рахит, слезотечение. Лечение проводится путем инъекций комплекса витаминов.
Не стоит забывать и о паразитах. Клещи, блохи, вши, глисты всех возможных видов могут не только стать причиной смерти, но и появления болезни у индюшки, так как являются переносчиками инфекций. Самый простой метод избавления от паразитов – дезинфекция помещения, можно также обработать птиц специальными препаратами, которые пропишет ветеринар.
Что советуют заводчики?
Самое трудное в выращивании индюшат – первые 10 дней их жизни. Именно в этот период они подвержены массе болезней, плюс хилость и малые размеры увеличивают риск получить травму. Так что в эти дни за ними нужен пристальный уход и присмотр.
В помещении, где содержатся индюшата, должно быть сухо и тепло
В помещении, где они содержатся, должно быть сухо и тепло. Если индюшата не сбиваются в кучу, подвижны, то их вполне устраивает микроклимат. Содержать их желательно в клетках, или ящиках с сетчатым полом. Если пол будет в мелкую ячейку 1х1 см, то птенцы не смогут клевать помет, который, так или иначе, мешается с пищей на полу, так как он просто будет вываливаться из клетки. Но важно чтобы ячейка была мелкой, в противном случае лапки у молодняка будут проваливаться сквозь решетку, и тут уже не исключены вывихи и переломы.
Любые болезни индюшат имеют свои симптомы, важно внимательно следить за молодняком, чтобы не пропустить ее или иные признаки. А как только они замечены, стоит вызывать ветеринара и начинать лечение.
Профилактика болезней индюшат
Советуем к прочтению другие наши статьи
Индюки довольно слабые птицы в плане здоровья, тем более их потомство, которое имеет тонкие конечности и неразвитую иммунную систему. Именно поэтому стоит принимать профилактические меры, чтобы хоть как-то снизить риски заболеваний индюшат.
- В индюшатнике и брудере где держат молодняк всегда должно быть чисто. Помет, остатки разбросанной еды, плесень на стенах – все это является излюбленной средой болезней, не стоит об этом забывать. Примерно раз в 3 месяца необходимо проводить дезинфекцию индюшатника и брудера.
В брудере где держат молодняк всегда должно быть чисто
- Влажность должна быть в пределах нормы, так же как и температура. Сквозняков стоит полностью избегать – заделывать все щели, закрывать форточки, если нужно, ведь молодые особи быстро простужаются.
- Выращивать индюшат необходимо отдельно от взрослых птиц. Это и сдержит болезни индюшат в случае их появления и поможет избежать заражения от взрослых индюков.
- Перед заселением молодняка в большое помещение, новые клетки или брудер, последние нужно хорошо продезинфицировать, вымыть с мылом.
- Корм должен быть всегда свежим, качественным, без плесени, грибков, неприятного запаха, который может возникать при длительном хранении.
- Остатки корма всегда выбрасываются перед подачей новой порции еды, от них у индюшат часто бывают запоры, расстройства. Кормушки и поилки моют перед каждой кормежкой.
Время от времени нужно осматривать индюшат на наличие болезней, травм, каких-то физических отклонений
- Время от времени нужно осматривать индюшат на наличие болезней, травм, каких-то физических отклонений. При обнаружении любых признаков недуга, особь отсаживают в отдельный брудер и вызывают ветеринара, чтобы тот составил план лечения.
Кроме того, чтобы индюшата не болели, стоит их прививать от болезней с самого рождения. Прививают обычно от самых распространенных инфекционных заболеваний. Провести процедуру можно в любой ветлечебнице или просто вызвать доктора на дом.
ВИДЕО — Профилактика заболеваний у индюшат с 6 по 45 день
Расстройство пищеварения индюшат
Растройство пищеварения у индюшат. Определение болезни по цвету. Симптомы и способы их решения.
При разведении домашних видов птиц заводчикам нередко приходится сталкиваться с некоторыми заболеваниями, которые связаны с питомцами. Болезни у птиц не являются редкостью, но в большинстве своем оказывают влияние на молодняк в возрасте одного месяца.
Наиболее распространенной проблемой у индюшат является расстройство пищеварения. Главное, вовремя понять, что стало причиной болезни, в противном случае птица может погибнуть.
Как определить болезнь по цвету
Индюшата могут страдать от нескольких разновидностей расстройства пищеварения. В основном первопричиной являются заболевания вирусного характера или корма ненадлежащего качества. Прямой контакт с паразитом также может вызывать понос.
Суть проблемы иногда может позволить выявить по цвету стула, он бывает:
• белым;
• черным;
• горчичного цвета;
• желтого;
• коричневого.
В некоторых случаях нет никакой опасности для молодняка, а в другом летальном случае будет избежать крайне трудно.
Коричневый понос
При появлении поноса коричневого цвета следует обратить особое внимание на то, что какой-то корм не является пригодным для употребления в пищу. С особым вниманием нужно отнестись к яйцам, нередко именно эта продукция нередко приводит расстройству пищеварительной системы. Чтобы нормализовать стул, индюшата дают листья крапивы или полыни.
В качестве профилактического средства можно использовать антибиотики, относящиеся к фтортрихнолам. Это поможет очистить птичий желудок от паразитов, а вместе с этим пройдет и коричневый понос.
Белый понос
Появление белого поноса заставляет серьезно задуматься о здоровье молодых птиц. Наиболее часто причина кроется в пуллорозе – инфекционной болезни, которая быстро распространяется на все поголовье.
В качестве первой помощи индюшатам можно дать ромашковый отвар или слабый раствор марганцовки. В том случае если через сутки после применения вышеперечисленных средств, понос белого цвета все еще не прошел, необходимо обратиться к ветеринарному врачу, который назначит лечение при помощи антибиотиков.
Пуллороз может возникнуть в случаях, если заражено оборудование, есть заболевшие птицы. Наибольшая восприимчивость заметна у индюшат, не достигших возраста в 20 дней. Если не начать своевременного лечения, то падеж может случиться у 70% молодняка.
Среди основных симптомов можно назвать следующие:
• дыхание становится тяжелым;
• птенцы нахохливаются;
• постоянно пищат.
Лечить можно левомицетином, фуразолидоном.
При гистомонозе наблюдается понос, имеющий горчичный цвет, кроме этого, у молодняка наблюдается общее недомогание. В некоторых случаях кал выходит с кровавыми сгустками. Здесь не обойтись без применения антибиотиков. Начав прием препаратов, можно ожидать гибель паразитов, вызвавших болезнь уже на третьи сутки.
Кал такого же цвета наблюдается и при Ньюкасле, борьба с данным заболеванием будет бессмысленной, если птица не была привита.
Желтый понос
При смене рациона, при переходе с одного вида кормов на другой или просто при вводе новых добавок может наблюдаться желтый понос. При отсутствии каких-либо еще симптомов, и продолжительности поноса дается раствор марганца.
Если развивается Ньюкасла, то кроме желтого кала наблюдается и паралич конечностей. Лечение будет иметь воздействие только в том случае, если птица прививалась при достижении определенного возраста.
Черный понос
Отравления характеризуются черным поносом, также он может наблюдаться при воспалительных процессах в желудке. Серьезное воспаление, когда слизистая оболочка слишком напряжена, в результате появляются небольшие кровоточащие трещинки. За счет крови происходит окрас кала в черный цвет.
Лечение начинается с выделения из общей группы заболевшего молодняка. Их пропаивают раствором марганцовки, ромашковыми или крапивными настоями, некоторые птицеводы дают зеленые сорта чая. Воспаленную слизистую лечат активированным углем как очень хорошим средством для борьбы с инфекциями кишечника.
описание самых распространенных заболеваний и их профилактика (95 фото)
Индюк – крупная домашняя птица родом из Америки. В Европу индюки попали в 16 веке и стали набирать популярность среди фермеров, которая не уменьшается по сей день. Это связано с тем, что индюшиное мясо является диетическим, оно содержит небольшое количество холестерина и много полезных витаминов.
Мясо индейки рекомендовано к употреблению беременным женщинам и маленьким детям, так как оно не вызывает аллергической реакции.
Прежде чем заняться разведением индюков, необходимо изучить некоторые особенности их выращивания. Уход за молодыми индюками не сложный, однако не у всех вырастают здоровые птицы.
Содержимое обзора:
Уход за индюками
Чтобы птенцы выросли здоровыми, нужно соблюдать основные правила:
- Первый месяц индюшатам необходимы дополнительное освещение и повышенная температура воздуха;
- Нужно беречь от сырости и сквозняка;
- Индюки подвержены инфекционным заболеваниям, поэтому каждый день необходимо чистить питомник;
- Выбирать специальный корм, содержащий витамины для птиц;
- Индюки любят свободу, поэтому место разведения должно быть просторным, иначе птица начинает болеть;
- Малоподвижный образ жизни также приводит к заболеваниям, поэтому индюков нужно выгуливать даже зимой.
Также необходимо знать какие болезни свойственны для индюков. Чтобы избежать проблем в будущем, можно заключить договор с ветеринаром, который будет постоянно осматривать домашних птиц и проверять на наличие инфекций, или отправлять в ветеринарную клинику самостоятельно по мере необходимости.
Болезни индюков
Рассмотрим основные заболевания, с которыми может столкнуться собственник индюков:
- Синусит;
- Гистомоноз;
- Паратиф;
- Пуллороз;
- Гельминтозы;
- Оспа;
- Кокцидиоз;
- Понос;
- Твердый зоб;
- Гиповитаминоз или авитаминоз;
- Артрит.
Первые семь болезней из списка являются инфекционными, которые передаются от одной особи к другой. Поэтому при обнаружении одной больной птицы, ее поселяют отдельно от всех остальным, а здоровым индюкам дают определенные лекарства для профилактики.
Не все заболевания требуют немедленного обращения к специалисту. Некоторые из них можно вылечить самостоятельно. Для этого необходимо научиться отличать симптомы и правильно определять, чем заболела птица.
Понос у индюков
Диарея не является сама по себе болезнью, это следствие различного рода заболеваний. Понос может быть симптомом многих болезней. Основные из них – это паразиты, неправильно подобранный корм, нерациональное питание. Для начала необходимо выявить причину поноса, так как он может привести к летальному исходу.
Если у птиц наблюдается коричневый понос, это указывает на неподходящее питание, вследствие чего ослабевает иммунитет. Для лечения необходимо пересмотреть питание. Также рекомендуется добавлять в корм измельченную крапиву с полынью.
Инфекционное заболевание пуллороз вызывает белый понос. Как лечить в таком случае понос у индюков: необходимо давать слабый раствор марганцовки и отвар ромашки. Нужно выпаивать всех птиц, даже здоровых.
Если в течение несколько дней, улучшений не наблюдается, нужно обратиться к специалисту. Он назначит антибиотики.
Понос желтого цвета появляется при введении прикорма у молодых особей. Если больше никаких симптомов нет, то рекомендуется на время исключить прикорм из рациона.
Синусит или респираторный микоплазмоз
Причиной заболевания синуситом является несоблюдение температурного режима или повышенная влажность в питомнике. А также неправильно выбранный корм дает осложнения на фоне снижения иммунитета.
Основные симптомы:
- Воспаление глаз;
- Потеря зрения;
- Выделения из носа и глаз;
- Снижение веса.
Профилактикой микоплазмоза является правильный рацион питания, поддержание нужной температуры и влажности, чистота и проветривание индюшатника.
Гистомоноз
Это болезнь, которая свойственна только индюкам, хотя переносчика могут быть и другие животные. Лечение гистомоноза в 90 % случаев не дает результатов, поэтому необходимо соблюдать меры профилактики.
Гистомоноз по-другому называют «черная голова», так как первым симптом является потемнение головы. Также отмечается снижение аппетита, потеря веса, зеленый понос, снижение температуры тела, нарушение работы печени.
При обнаружении гистомоноза, птицу необходимо изолировать, а помещение дезинфицировать. Заражение происходит через корм, воду.
Для лечения индюков используют Метронидазол. Это противомикробное и противопротозойное средство. Его также дают молодым индюшатам для профилактики от гистомоноза.
Для профилактики и для лечения необходимо давать разные дозировки. Профилактика проводится в течение одной недели. Лечение длится две недели – если улучшений не наблюдается, птицу уничтожают.
Кокцидиоз
Кокцидиоз – это инфекционное заболевание, которое очень быстро распространяются по всему организму. В основном эта болезнь свойственна молодым птицам.
Симптомы кокцидиоза у индюков:
- Потеря аппетита, снижение веса;
- Вялость;
- Птенцы издают жалобный писк;
- Постоянно хотят пить;
- Перья выглядят неухоженными;
- Понос.
Лечение кокцидиоза проводится с помощью антибиотика, который назначает ветеринар. Лекарство смешивают с кормом и дают птицам.
Заболевание оспой
Переносчиком оспы являются паразиты, насекомые, другие птицы. Также болезнь передается через воду, корм, поильники, подстилку.
При заражении оспой у индюков наблюдается боязнь света, снижение аппетита, птица теряет перья. Если посмотреть на фото индюков, заболевших оспой, можно увидеть многочисленные красные пятна по всему телу, особенно на голове.
Лечение оспы у индюков не проводится. Всю зараженную птицу уничтожают. В качестве профилактики специалисты рекомендуют делать вакцинацию от оспы всем индюкам.
Артрит у индюков
Избыток белка в корме приводит к артриту суставов или другими словами воспалению суставов ног. При артрите наблюдается нарушение двигательного аппарата, птица криво ставит ноги, затем большую часть времени сидит, так как испытывает боль при ходьбе. Также артрит может появиться в случае, если индюков содержат в тесных клетках и не выводят на прогулку.
На ранних стадиях лечения артрита индюкам прописывают ампициллин. Его дают в течение пяти дней, затем делают недельный перерыв. После этого снова дают пять дней. Такая схема сохраняется до полного выздоровления.
При правильном уходе и своевременном лечении и профилактики болезней, разведение индюков не покажется трудным, а также может стать прибыльным бизнесом.
Фото лечения индюков
Также рекомендуем просмотреть:
Болезни индеек и их профилактика. Самый полный справочник птицевода
Болезни индеек и их профилактика
Пастереллез (холера) птиц – заболевание, протекающее в острой и хронической формах. Чувствительны к пастереллезу индюшата в возрасте 30–60 дней. При остром течении болезни в первую очередь погибают упитанные индейки (через 17–48 часов). Возбудитель болезни – пастерелла – сохраняется в навозе до трех месяцев, на загрязненных пометом предметах – 12–72 дня. На открытом воздухе под прямыми солнечными лучами пастереллы погибают за 48 часов, а при рассеянном свете – за 72 часа.
Пуллороз (бациллярный белый понос) – опасная для индюшат болезнь. Источники инфекции – больная птица, зараженные яйца, оборудование. Больные индюшата плохо растут и во взрослом состоянии являются бациллоносителями. Пуллороз вызывает значительный падеж молодняка.
Тиф – острое инфекционное заболевание индеек, наиболее распространенное в южных районах страны. Болеют им индейки всех возрастов, но чаще взрослые в возрасте до 150 дней. Возникновению и распространению болезни способствуют неполноценное кормление, скученность и антисанитарное состояние помещений. Тиф вызывает значительный отход птицы, а переболевшая индейка долгое время выделяет возбудителя тифа с калом, яйцами и является источником инфекции.
Индейки могут заразиться тифом от кур, у которых эта болезнь протекает скрыто, поэтому контакты индеек и кур нежелательны.
Всю больную и подозреваемую в болезни птицу забивают, помещение и выгул дезинфицируют, а здоровой птице скармливают лекарственные препараты.
Опасная болезнь для индюшат в возрасте 3-30 дней – паратиф. Смертность молодняка при данной болезни достигает иногда 80 %. Заболевшие индюшата становятся вялыми, у них отвисают крылья, иногда наблюдается понос. Источник распространения инфекции – больная и переболевшая птица, а также яйца, снесенные индейками-бациллоносителями.
Возникновению паратифа способствует неполноценное кормление, в частности, недостаток витаминов, нарушение условий содержания – увеличение плотности посадки птицы, плохая вентиляция и антисанитарное состояние птичников.
Туберкулез – хроническое заболевание индеек, преимущественно взрослых. При туберкулезе поражаются печень, селезенка и другие внутренние органы. У больных индеек иногда наблюдается понос, они худеют, резко снижают продуктивность. Возбудитель болезни – туберкулезная палочка. Она очень устойчива к условиям внешней среды и трудно обезвреживается обычными дезинфицирующими средствами. Наиболее эффективным средством борьбы с туберкулезной палочкой являются солнечные лучи. Они ее убивают за 45–50 минут, а рассеянный свет – за 8-50 дней.
Помещения, в которых содержалась больная птица, после дезинфекции оставляют на один-два месяца с открытыми оконными рамами.
Распространяется болезнь через больных птиц, грязную подстилку, корм, воду, иногда через яйца, снесенные больными индейками.
Респираторный микоплазмоз имеет несколько названий – инфекционный синусит, хроническая респираторная болезнь или заразный насморк.
Болезнь возникает и усиливается при неблагоприятных условиях содержания: переуплотнении, переохлаждении, недостаточной вентиляции, сырости, неполноценном кормлении, особенно при дефиците витаминов А и D.
Синусит поражает, главным образом, индюшат с трехнедельного возраста и старше. Болеет также взрослая птица.
Заболевание наблюдается в основном осенью и зимой. Главным источником инфекции является больная птица, выделяющая возбудителя с носовым истечением на подстилку, корм и воду. Накопление слизи вызывает у нее припухлость подглазной области, при этом воспаляется слизистая оболочка глаз, нарушается зрение, птица не может находить корм. Больная птица теряет продуктивность, худеет и погибает, переболевшая долго остается бациллоносителем.
Особое значение в профилактике синусита имеет выращивание молодняка на выгуле. Индюшата в дневное время суток должны находиться на свежем воздухе.
При клеточном содержании надо обеспечивать хорошие микроклимат и кормление, соблюдать нормы посадки птицы.
Большую опасность для индюшат в возрасте четырех месяцев и старше представляет рожа, вызываемая возбудителем рожи у свиней. Она может передаваться индейкам от больных птиц, свиней и овец. Заболевшие индюшата становятся вялыми, нахохливаются, голова и кораллы у них синеют, мясистый отросток на голове припухает, наблюдается истечение слизи из носа, повышается температура тела до 43–44 °C.
Источником заболеваний индеек могут быть грызуны, которые разносят инфекцию.
Индейки, как и куры, болеют оспой (осподифтерит). Возбудитель болезни – фильтрующий вирус. Переносят инфекцию больные и переболевшие индейки, куры, голуби и птицы других видов.
У больных индюшат на голове, шее, крыльях образуются серовато-желтые наросты в виде бородавок. При дифтерической форме налеты появляются в ротовой полости, гортани и могут вызывать удушье, иногда поражают глаза, и птица слепнет.
Больных индеек забивают, подозрительных изолируют в другое помещение.
Чаще оспой заболевают индюшата с месячного возраста. Индейки старше года довольно устойчивы к оспе. Смертность индюшат при оспе небольшая, но они резко отстают в росте и развитии, у взрослой птицы снижается продуктивность, оплодотворяемость яиц, вывод молодняка.
Чума – острое заразное заболевание, вызываемое вирусом. Эта тяжелая болезнь отмечается во всех континентах земного шара. Особенно чувствительны к ней индюшата моложе трех месяцев, падеж может достигать 50 %. Взрослые индейки более устойчивы к чуме, чем молодняк, однако падеж иногда составляет 20 %. У больной птицы наблюдаются понос, припухание зоба, высокая температура.
Источником распространения чумы являются больная птица, мясо убитых птиц, люди, обслуживающие больную птицу, тара для перевозки мяса и яиц, подстилка, инвентарь.
Основные профилактические мероприятия по борьбе с чумой должны быть направлены на предотвращение попадания инфекции в здоровое стадо. В случае возникновения заболевания всю птицу забивают, помещение и инвентарь тщательно дезинфицируют.
Перед разведением следующей партии индеек необходим продолжительный профилактический перерыв.
Орнитоз – инфекционное заболевание, опасное не только для индеек, но и для человека. Орнитозом болеют все виды сельскохозяйственной птицы.
Возбудитель болезни – вирус, который даже в высушенном состоянии под вакуумом сохраняется несколько лет, но погибает под действием растворов обычных дезинфицирующих средств.
У больных орнитозом индеек снижается продуктивность, наблюдаются сонливость, шаткость походки, исхудание. Гибель птицы может достигать 20–30 %.
Заболевших орнитозом индеек забивают. Трупы умершей птицы уничтожают.
Большой ущерб птицеводству наносят протозойные, глистные и паразитарные болезни. Из них наиболее распространен гистомоноз, который вызывает одноклеточный организм класса жгутиковых – гистомонада.
Проникновению гистомонад в стенку кишечника индеек способствует личинка глиста гетеракис, паразитирующего в слепых кишках индеек.
Гистомонозом чаще болеют индюшата в возрасте от двух недель до трех месяцев, но нередко поражается молодняк старшего возраста и взрослая птица. Индейки могут болеть гистомонозом в течение всей своей жизни.
Распространяют гистомоноз взрослые больные индейки, которые выделяют с пометом огромное количество паразитов. Куры, являясь постоянными носителями гетеракисов, также заражают ими индеек. Кроме того, источником заражения индюшат являются загрязненная подстилка, инвентарь, транспорт, тара, инкубационные яйца, обувь, одежда обслуживающего персонала.
Больные гистомонозом индюшата теряют аппетит, жалобно пищат, испытывают жажду, дрожат, у них наблюдаются вялость, взъерошенность, иногда появляется понос желто-зеленого или коричневого цвета, перья вокруг клоаки загрязнены.
Основными профилактическими мероприятиями при гистомонозе, наряду с полноценным кормлением, является соблюдение санитарно-профилактических мероприятий, тщательное проведение дезинфекции, соблюдение зооветеринарных требований по уходу за птицей.
Профилактика заболеваний индеек – важнейшая забота всех птицеводов.
К основным средствам санитарно-профилактических мероприятий относятся: дезинфекция, дезинвазия, дезинсекция и дератизация. В качестве дезинфицирующих средств используют горячий 5 %-ный раствор кальцинированной соды, 20 %-ную взвесь свежегашеной извести, 2 %-ный горячий раствор едкого натра, 3 %-ный раствор каустической соды, 3 %-ную горячую эмульсию креолина и др. Мелкие предметы и инвентарь дезинфицируют погружением в горячий раствор, спецодежду кипятят. Кормушки, поилки в индюшатниках не демонтируют, их чистят и моют на месте. Стены белят свежегашеной известью.
После проведения профилактической дезинфекции помещение закрывают не менее чем на 3 часа, а затем хорошо проветривают.
Дезинвазия – это борьба с глистными заболеваниями птицы. Ее проводят с целью уничтожения яиц и личинок различных глистов. Профилактическую дезинвазию, в случае необходимости, совмещают с дезинфекцией.
Дезинсекцию и дезакаризацию помещений и окружающей их территории осуществляют с целью уничтожения эктопаразитов птиц (внешних паразитов, обитающих в коже и оперении) – клещей, клопов, пухопероедов и пр. Помещения следует обрабатывать после реализации выращенной птицы. Требуется тщательная обработка щелей, пазов и других мест, где могут гнездиться паразиты. Применяют 2–5%-ный раствор хлорофоса, 0,25-0,3 %-ную водную эмульсию карбофоса.
Через сутки после предварительной обработки помещение и находящиеся в нем инвентарь и оборудование чистят и моют горячей водой, а затем проводят повторную дезинсекцию теми же средствами в несколько меньшей концентрации.
⋆ Выявление и лечение пуллороза кур и цыплят ⋆ ✓ Фермер
Инфекционное заболевание птицы отрядом пуллулороза цыплят поражает довольно часто, что приводит к гибели молодняка.
Содержание
- Справка о характере пуллороза
- Этиологическая картина пуллороза
- Эпизоотология <
- Патогенетическая и клиническая картина брюшного тифа
- Патогенез инфекции
- Клинические изменения
- Клинические признаки
- Острое развитие
- Подострое и хроническое развитие
- Патологии <
- Лечение и профилактические меры
Пуллероз и ороз домашней птицы
Информация о характере пулороза
Инфекция, называемая инфекцией домашней птицы, относится к кишечной инфекции паренхиматозных органов и вызывает у взрослой птицы воспалительные процессы в яичниках, приводящие к желточному перитониту.Среди других видов инфекционных заболеваний — дизентерия, бациллярная белая диарея (диарея).
Отличительной особенностью пуллороза у кур является бессимптомное течение.
Первые случаи массового выпуска птиц паллороза наблюдались в 18 89 году. Тогда английские ученые назвали это заболевание сальмонеллезом птиц. Возбудитель пуллороза у домашней птицы был выявлен в 1900 году, брюшной тиф, пуллороз должен был быть зарегистрирован на территории Европы в 1913 году, кишечная инфекция появилась на российских птицефабриках в 1924 году, когда были завезены цыплята и индюшатина с признаками этого заболевания.
В результате воздействия пуллороза на молодняк количество смертей среди кур достигает 70%. При этом экономический ущерб от него также связан со снижением продуктивности взрослых цыплят, снижением их яйценоскости и выводимости нового поколения из-за проблемы эмбрионального развития плода. При развитии пулороза молодые цыплята и индюшатины начинают худеть, что напрямую влияет на племенные характеристики птицы.
Этиологическая картина пуллороза
вызвана возбудителем отряда сальмонелл, который представляет собой стационарную грамотрицательную палочку, не образующую ни спор, ни капсул. Микробиология относит возбудителя брюшного тифа к аэробам.
Для активности инфекционной палочки наиболее оптимальной является температура 38 ° C при щелочном pH 7,5.
В обычной питательной среде аэроб достаточно быстро развивается, легко образуя округлые формы, полупрозрачные колонии с четкими очертаниями и слегка выступающей влажной поверхностью.пуллороз может размножаться в грубом виде, затем разрастается сухими колониями.
Возбудитель брюшного тифа обладает значительной устойчивостью к внешним факторам: в птичьем помете пуллороз сохраняется 100 дней, в условиях маловодья — до 200, в слое почвы — до 400. При В то же время в условиях птичьего помета, который не подлежит замене в течение 10 дней, возбудитель пуллороза птиц погибает.
Ученые заметили, что аэробный пуллороз, попавший в садоводческую культуру при поддержании температуры в пределах 18-20 ° С в высушенном состоянии, способен жить до 7 лет.
Продолжительный период активности пуллорозной инфекции наблюдается в условиях замораживания до 180–190 дней. Инактивировать вирус пуллороза можно при нагревании до 60 ° C не менее получаса. При температуре кипения аэроб погибает всего через минуту, при приготовлении зараженного куриного яйца — через 7-8 минут.
Различные препараты и растворы могут привести к гибели инфекции:
- 1% формалин способен уничтожить пулороз за 5 минут,
- для инактивации карболовой кислотой, требуется концентрация 5% и полминуты,
- справится с марганцем, нафтазолом, отбеливателем за 15-20 минут с активным хлором.
Ученые отмечают чувствительность пулоровых бактерий к препаратам из ряда антибиотиков, по поводу вызывающей привыкание инфекции Нако наблюдается при лечении длительным применением одного и того же медикамента.
Эпизоотология
Помимо домашней птицы (индюки, индюки, куры, куры, цесарки, фазаны и перепела из отряда кур) среди других животных, склонных к пульлезу, появляются кролики, декоративные свиньи и мыши. У водоплавающих птиц отмечена небольшая устойчивость к пуллорозу птиц.
Среди бройлеров брюшной тиф поражает в основном мясных птиц. Наименьшие случаи паллороза у кур наблюдались у тех видов домашней птицы, которые вылупляются для получения яиц.
Основной путь передачи болезни — эмбриональный, когда инфекция передается через инфицированные яйца новорожденным молоднякам. Отмечается до 50% таких случаев.
Пуллороз наблюдается у молодняка в зависимости от возрастной категории:
- 5-7-дневные цыплята болеют пуллорозом чаще, заболевание прогрессирует у них более 20 дней,
- — по достижении 20-дневного возраста. и далее количество заболевших у кур уменьшается, переходя в подострые формы протекания или хронического развития.
Передача кишечной инфекции происходит разными путями:
- Как источник передачи возбудителя, больные молодняк и взрослые курицы, несущие бактериальный акт AI, который вместе с фекалиями выводит в окружающую среду пуллороза в большой концентрации. возбудителя.
- проникновение пуллороза в куриные яйца происходит через содержимое кишечника заболевших лиц через поры скорлупы,
- бактерии, источники пуха, отходы, питьевая вода, пища, оставшаяся после зараженного расплода,
- носители болезни — городские птицы (воробьи, голуби, галки).
Обычно только от 25 до 50% цыплят выводятся из яиц, инфицированных паллорозом, остальные погибают во время эмбрионального развития.
НАИБОЛЕЕ ЧАСТЫЕ ЗАБОЛЕВАНИЯ КУРИЦ: симптомы и лечение болезней кур! (Ветеринар Павел Шкурманов)
Вакцинация цыплят против болезни Ньюкасла.
О куриных болезнях! (впечатлительный, чтобы не смотреть и не слушать)
Патогенетическая и клиническая картина брюшного тифа
Среди факторов, способствующих возникновению и развитию пуллороза у кур и кур, многие связаны с условиями содержания домашней птицы и качеством ее корма:
- плохое питание и несоблюдение графика кормления,
- теснота птиц в птичнике,
- перегрев или переохлаждение особей.
Патогенез инфекции
При попадании возбудителя внутрь организма птицы, в месте проникновения, например, слизистых оболочек кишечника, желудка, легочной системы, начинает размножаться и по кровеносной системе начинает распространяться во всех внутренних органах, что приводит к патологии сердца, печени, почек, яичников, селезенки.
В процессе размножения пуллороз выделяет токсины в организм, что приводит к гибели эмбриона.
К моменту вылупления большинство цыплят уже являются переносчиками пуллороза, который проявляется признаками острой интоксикации. В организме взрослой птицы возбудитель светится в органах яйцекладки и время от времени выделяется вместе с яйцекладкой.
Среди последствий передачи пуллороза птицами при надлежащем лечении — иммунитет к кишечной инфекции, развивающийся против кишечной инфекции из-за образования антител у цыплят, перенесших пуллороз.Эта особенность легла в основу селекционной работы при выведении линий кур, устойчивых к брюшному тифу.
Клинические признаки
Латентный период пуллороза птиц может длиться от суток до 20. Причем выделяют:
- врожденная форма, при которой цыплята уже инфицированы путем вылупления из инфицированных яиц,
- постнатальная форма, когда здоровые люди заражаются от пациенты в процессе их совместного содержания.
При врожденной форме, развивающейся через 3-5 дней, заболевание проявляется у кур в виде общей слабости и ливых состояний.Молодняк теряет аппетит и отказывается от еды, передвигается с опущенными крыльями. Среди физиологических симптомов — белая жидкая диарея. Аналогичные клинические признаки у инфицированных постнатальным методом, который прогрессирует от 2 до 5 дней.
Течение инфекции и патологические изменения
Количество летальных исходов при пульулезе птиц достигает 70% и зависит от формы развития заболевания.
Острая форма развития
Наблюдается через 3 дня в неделю и сопровождается одышкой, нарушением координации движений цыплят, неподвижностью птиц.Обычно больные особи замирают без движения с закрытыми глазами, широко расставленными ногами, что ветеринары часто демонстрируют на фото как хороший пример клинической картины. Отмечается повышение температуры до 44 ° C. Основным симптомом острого развития пуллороза является обильный белый понос. Исход острого тифа в большинстве случаев летальный, через 10-15 дней.
Подострое и хроническое развитие
Такие формы течения болезни характерны для 2-3-недельных птиц и взрослых цыплят.Цыплята начинают терять в приросте, становятся малоподвижными, отстают в развитии. Если птиц лечить антибиотиками, большинство кур выздоравливает.
У взрослых бройлеров симптомы пуллороза не наблюдаются, заболевание протекает без особых клинических признаков. Лишь изредка можно отметить изменение яйценоскости в сторону уменьшения. Некоторым особям характерны вялые состояния, снижение аппетита. При обострении птичьего тифа фиксируются случаи жажды и одышки.Несушками развивается перитонит. При проявлении пуллороза у бройлеров отмечается хромота и появление артрита, в коленных суставах опухают. Смертность взрослых бройлеров составляет не более 5%, если их лечить вовремя.
Патологии
Наблюдаются патологические изменения внутренних органов в результате развития пуллороза в организме при вскрытии эмбрионов, молодняка и взрослых особей:
- увеличение печени, селезенка и желчный пузырь, наполненные темно-зеленой желчью,
- накопление солей белой мочевой кислоты в прямой кишке,
- наличие очагов некроза в легочной ткани, сердце,
- воспалительных процессов кишечника,
- наличие фолликулярного воспаления.
В соответствии с полученными эпизоотологическими данными хирурги ставят диагноз с учетом клинических признаков, возраста птицы, полученных патологических исследований. Окончательный диагноз ставится при бактериологическом исследовании свежих трупов птиц или при диагностике взрослых особей in vivo по реакции капли крови.
Лечебно-профилактические мероприятия
Одним из наиболее эффективных средств профилактики пуллороза является бактериофаг, применяемый внутрь в дозировке 2 мл.Вводится дважды с интервалом в 2 дня. На третьи сутки этот препарат применяют в виде инъекции подкожно в объеме 0,5 мл.
Лечение заболевших лиц проводится антибиотическими препаратами, среди которых:
- фуразолидон, смешанный с кормом в концентрации 0,04-0,06% в течение 15 дней с повторной обработкой после 3-5 дневного перерыва,
- менее токсичный фуридин с дозировка 200 мг на 1 килограмм веса, добавляемая в корм на 10 дней,
- широко применяется в качестве добавки к кормам и питьевой воде сульфадимезин в объеме до 1% в течение 2 недель с повторением с интервалом 2- 3 дня,
- комплекс авидокса и колимицина.
В случае выявления случаев брюшного тифа и постановки окончательного диагноза ветеринарной службой исполнительной властью региона принимается решение об объявлении неблагоприятной ситуации и начале ограничительных мер по разведению кур и индейки, комплексное лечение и убойную зачистку.
Узелки кишечника и суставов — Veterinaria Digital
Поиск
Контент
Все типыНовостиСтатьиБлогиСобытияКомпанииКартина неделиКорпоративная культура
Категория
Все категорииАнтибиотикиАнтиоксидантыАквакультураДезодорантДижестивыРаспространениеФерментыСобытияУправление фермойЖирыКормлениеВкусИммуностимуляторыМикробиоцидМногофункциональныеМикотоксиныПитаниеПатологияФармакологияКартинкаПтицеводствоРезерводство
Тэг
Все TagsAbdominal FatAcidosisActinobacillus suisAdditivesadenoviridaeadenovirusAflatoxinAflatoxinsAfrica-enAGP Антибиотик Рост PromotersAgrenaair sacsALAAlquerfeedAlquermold NaturalAlquernat NebsuiAlquernat YuccaAlquernat Zycoxalternative cerealsAmoniacoAMVECAJAnimal корма feedanimal additivesanimal healthanimal healthAnimal Husbandryanimal productionanimal welfareantibiotic рост promoterantibiotic свободной chickensantibioticsantibodiesAnticoccidial planantioxidantsAntiviotic свободной eggsAquacultureaquaculture lightingAquaculture productionAquaculture productionArterial hypertensionArtificial InseminationAscitesAsia-enAspergillus-enatlasatlas patology’savesuiavian diseasesavian fluAvian инфекционное bronchitisAvian инфекционно-токсический гепатоэнтерит, птичий грипп, микоплазмоз птиц, пулороз птиц, септицемия птиц, Награды, бактерии, бактерицидные бактерии, статические бактерии, сбалансированный корм, Бангкок, Бангладеш, говядина, крупный рогатый скот, биогаз, биомасса, биогаз, биогаз vetBiovet AwardsBiovet SymposiaBirdsblackhead diseaseBone fracturesBovineBovine-enbreedersbreeding sowsBroiler managementBroilersBroilersbroilersbroodinessbroody hensBursa из Fabriciusbutyratecaecal coccidiacage-freeCagescages для укладки hensCAHEcalciumcalves’ immuneCampylobacter jejuniCampylobacteriosiscapillariacaptadores де micotoxinascarbon dioxideCattle farmingCellsCentral Americachemical coccidiostatsChicken breedsChickensChileChinaCimenol RingClostridiumClostridium perfringenscobayacobayoCoccidiacoccidicidescoccidiosiscoccidiosiscoccidiostatscochlosomiasisCollaborationcolostrumcommercial утка productionconditioner pronutrientsConditioning свиньи barnconejillo де indiasConferencesConjuntiva глазное -enCorneal слой gizzardcoronaviruscovid 19cuyeCyanosis earsCystsDairy CattleDecalcificationdeep Постельные принадлежности systemDermatitis синдром свиней нефропатия, дерматит и искривление килевой кости, головная боль у телят, пищеварение у рыб, пищеварительный микоз, пищеварительная система, пищеварительный тракт, грязь eggsdiseaseDisease preventiondisease vectorsdisinfectionDisseminationDuckDuck breedsDuck eggsduck managementDuck meatDUCKSDuodenal foamEar NecrosiseditorialEggEgg DayEgg depigmentationegg layingegg productionegg qualityegg qualityeggs productioneggs transportEggsCargoSystemEggshellEggshell defectsEimeriaEimeria acervulinaEimeria tenellaEndocrine SystemEnergy savingEnteritis вызваны жира acidityEnteritis-enEnterobacteriaEnzyme deficiencyEnzymesEP2 ReceptorEquineEscherichia палочка -enEuropeeventeventosEvolutionExothermalExpositionfacilities для layingfairFami QSfarm managementfarm ventilationfarmingFatty liverfeaturedfeedfeedfeedingFeverFishfish feedfish productionFishmealFlavoringFlavoringsflufood coloringsFood safetyFood safetyFootpad dermatitisFormaldehydeFormaldehyde burnsFowlpoxfungifungicidalFusarium-enGangrenous dermatitisgarantía де calidadGas in cecagastrocnemius желудочно-кишечные симптомы гусиГенетикаГеотермальная энергияGi-OvoМизокКозье молокоХорошее качество водыЗеленый желтоккгрегат иня в shrimpGrow-finishguinea pigguinea pigsGumborogut microbiotahatchabilityheat stresshelminthHemorrhages в основании живота в troutHemorrhages в systemHemorrhagic enteritisHemorrhagic жирного liverHemorrhagic репродуктивного syndromehen productivityHepatitisHepatoregeneratorsHigh fiberhistomoniasisHydroelectric powerHygiene и disinfectionhyperprolific sowsIBVIleocecal valvesIleusimmune deficiencyImmune SystemImmune systemimmunityImmunoboostersImmunodeficiencyimportance из colorsincubationINDIAN БЕГУНОК DUCKinfectious bronchitisInfectious bronchitisInfectious bursalInfectious синуситов из turkeyinfluenzaInfraorbital sinusesInmunosupresiónInterviewintestinal biocideintestinal conditionerintestinal кондиционера pronutrientsintestinal эпителий, кондиционеры слизистой оболочки кишечника, оптимизаторы слизистой оболочки кишечника, лапша, оптимизатор кишечника, оптимизатор пронутриентов кишечника, физиология кишечника в процессе яйцекладки, ворсинки кишечника, благополучие кишечника, кишечник, узелки в суставах, ХАК Я CAMPBELLkidneykidney urateslactationlarval feedingLatin AmericanLatin American Poultry AssociationLawsonia внутриклеточными-enLayerslayers increaselaying henlaying henLesions в kidneylevantelibre де jaulalighting в broilersLighting в домашней птицы housesLive Poultry transportLiverliver conditionerLiver кондиционирования pronutrientsLiver regenerationLiver стеатоза в broilersLivestock из Chinaload из eggsLunglymphocytesmacrophagesmagazinemain pathologiesmanejoMatch-makingMeckel в diverticulummethaneMicrobiocidemicrobiotaMicroorganismsMigratory birdsmilkmilk qualitymilkingmilking systemsMineralsMinervet-enMucormycosisMucormycosis кишечника avianMULARDMuscle bleedingMUSCOVYMusculoskeletal SystemMycoplasma synoviaeMycoplasma -энмикоплазма-энмикозы при птицемикозеМикоз в желудкеМикотоксин связующееМикотоксиныМиопатияНатуральные добавкиНатуральный консервантНекротический энтеритПонос у новорожденных Неонатальный диареяанефритнефропатиянефропатический синдромНьюкаслБолезнь НьюкаслаЗитранПитание isOnline Exhibitionorganic acidsOrganic Productsorganic wastesOrnithobacterium-enOvarian infectionOvaritis infecciosa -enOviductOvineovumoxidative stressPakistanpalatabilitypandemicpapillomatosisParasite controlParasitesParasitosis-enparvoviruspathogenPathologyPEDPEKIN DUCKPenelope albipennisPericarditis-enPeritonitis-enperúpesticidesPetechiaePetsPHOTOPERIODPigPig FarmingPig housingpig productionPiglet handlingpigletsPigmentspigsPleuritis-enPododermatitis-enPolyserositisPoor качество fatsporcine эпидемии diarrheapostPost-weaningPoultrypoultrypoultry farmPoultry дом disinfectionpoultry productionPoultryFarmPrebioticspreservativepreservative additivespreservative productsPreservativespreventionprobioticsProduct qualityproduction параметры в geeseproductive параметры в отлученных от pigletsPromoters всасывание минераловПронутриентыпроцентные оптимизаторыбелковый избытокПротеус -enprotocolPseudomonasPULLETSQS сертификатКачество свининыR & DRabbitsРактофаминсырьяПодводные молодкирецы rculation systemsrecríaRenewable energyReproductive помощь techniquesreproductive techniqueResearchResearch и DevelopmentRespiratory SystemRevolving doorsRuminantssalmónSalmonellaSalmonella-enSalmonellicidesSalmonellosissalmonidssalpingitisSarcoptic scabiessea licesea головы синдром LicesemenSeminarSepticemia-ensheep в milkShigellashrimpshrimpshrimp farmingshrimp productionSilicoglycidolSimposiumSimposium BiovetsineaceSinusitis-ensmallpoxSoft скорлупой eggsSolar energySouth AmericaSoutheast AsiasowsstallionsteatosisStomachStress preventionSub Сахары Africasustainable aquacultureSwineswine feverswine fluSwine influenzaSwine Productionswine reproductionSwine Salmonellosisswollen в poultrySymposiaTechnical conferenceTechnical visitstechnonewstendonitisthe liverThigh fattilapiatilapia farmingtilapia productiontooltoxicologyToxinsTraining сеанстранспорттрихотеценыТурцияИндейкитифлитУраты в сердцевакцинациявакцинациивакцинальный иммунитетвакцинывектамОвощи ветеринарный врач gazineВетеринарияВетеринарная этнологияВетеринарные опытыВИДЕОКОНФЕРЕНЦИИВирусный энтерит утокВирусный гепатит утоквирусВитаминыvivVIV ЦиндаоVIV Циндао 2020Качество воды отлучениеБелая мышца Сила ветраЯлколькольколький цвет Желток без поглощения оксида цинка
Дата начала
Дата окончания
Автор
Все авторыDr.Марко А. Эрнандес Экайц МагурегиДр. Оскар Ф. Уэртас АльваDr. Эстефания МесаДр. Мартин КероДр. Germán BertschDr. Антон Таллерольдо. Альберт Курто Альфонсо Диас (INPSAS, Колумбия) Dra. Мария СорианоДра. Джудит Плаза Альмольда Роберто С. Минетти Уильям Руис Национальный университет дель Литораль Р. Альфонс Гнанараджан Дра. M de Àngels Кальво Торрас Альфредо Паломино Альтаф ГохарАндритра / Δ’LabsIng. Херардо Майораль ГарсияDr. Христос Цадилас Колапо АджувонД-р. Lluis Pons AngladaScientiae Doctor Manuel RosembergLda.Marta DompabloDra. Эльвира КаноДр. Дэвид Диес АриасPronutrientesJosep SendraDra. Ноэми ЛоренцоПроф. Rafael MujeriegoConferenciaVideoconferenciaDra. Кристина ЛатасаPlantas naturalesAromasDr. Хуан Сабатер Тобелла Дра. Адриана Сиурана МаринаЛдо. Фернандо Р. ФейхтерVDTechnonews VDDra Evangelina ZárateLda. Мария СабатеRedactorDe res Agricolae (Columel·la) TucídidesColaboradores VDVeterinaria DigitalDr. Хайме Боррелл ВаллсМед. Вет. Лилиан Чеа СотоДр. Карлос КуэнкаДра. Лилиана РеволледоПроф. Энрике ЭрнандесАмир Х. Нилипур, доктор философии Антонио Пратс ЭстевеDr. Франсеск Монне I OrgaDra. Сара Боррелл Энцо РодригесMVZ Габриэль Руис КастаньедаДра Ана Магдалена МаркулескуДра. Сиао ВуХосе Диас Р., Исабель Кога Й, Даниэль Фернандес Т., Арнальдо Альварадо С., Роберт Тиноко Р. и Фернандо де ла Крус С. Мед. Вет. Хосеп СендраД-р. Роберто Хименес Торрес, доктор Ренан Медина Доменсайн, доктор Габриэль Руис Кастаньеда, дра. Марта Эльба Гутьеррес Варгас Эдуард Торрес Josep Llupià i MasDr. Ермаков Вадим Васильевич Тенгиз Ф. УрушадзеХоаким Бруфау и Де Барбера Альберт Сан Габриэль Питер С. Доэрти Артуро Анадон НаварроД-р. Джоан Ногареда i GifreDr. Даниэль БаботДр. Виктор Хьюго Санчо Варгас (Víctor Hugo Sancho VargasMateu Torrent i MollevíDr. Хосеп СендраД-р. Рикардо М. Алесон, Энрик Эстев-Гарсия и Ньевес Креспо Хосе Марин Санчес Мурильо, доктор Франсиско Хосе Родригес-Армихо Шардоннер, доктор Хосе Мария Гомес-Ньевес Родригес дель Кастильо Эдгар Санчес ПухальсДра. Памела Пенья и Лилло ГаданДра. Анна ТесуроДр. Виктор Угуэ, Энцо Родригес Ортега, Дра Нурия Мартин Гайрал, Lda.Анна ФариньясДр. Spadoni, E .; Д-р Ван ден Бош, С .; Доктор Родригес, G .; Доктор Таккини, Ф .; Доктор Савиетто, M.MV. Júlia Pié OrpíNatia CheminavaDra. Альба Видаль Лурдес де лас Эрас АлегретДра. Мария СорианоЭдди ОтаолаНеизвестноДра. Лаура Ройдж Франсиско Лопо Хосе Хавьер ЛатасаЛда. Marta DompabloDr. Альфонсо Собальварро Дэвид Диес АриасМед. Вет. Evangelina ZarateDra. Эльвира КаноЛда. Нурия Алкобер Сантьяго ЯпураVeterinaria DigitalLda. Соня Марзодра. Natividad CasasMed. Вет. Лилиан Чеа СотоДр. Ферран БоррасЦао ХунвэйЛдо. Миндаль Марцо БалдовиноДра. Siao WuDr. Пебло ТигрисДр. Карлос Доменек Эдуард Торрес Мигель Анхель АльгомедаДра. Анна ТесуроДр. Хосеп СендраДра. Эстефания Ф. Ребулль Нарцис КсатрухД-р. Hugo PatiñoLda. Anna FariñasLda. Селия MosteiroDra. Сарка Колачкова де МендезЛдо. Эдгар СанчесЛда. Natia CheminavaLda. Мария СабатеДра. Эстефания МесаДр. Альфредо Родригес Хайме Боррелл ВаллсЛдо. Энцо РодригесДра. Сара БорреллЛда. Тереза М. АгюллесД-р. Владимир де ла Мора, Сун Цу, Ямамото, Цунэтомо, Хилари Хинтон, Зиглар, Генри Чесбро, Шинмен Мусаси, Хуан Хосе Арета, Марк Хантер, Уоррен Беннис, Либре, «7 принципов Аюрведы», публикуемый в знаке XX AC Паскаля Теллиера, Крис Чемберс, Винсент Ван Гог, Крис Чемберс, Сэндливер, МусасиСтоуэлл, Томас Генри Хаксли, Дуигт Э. Эйзенхауэр, Ноэль Кларасо и Серрат, Эмиль-Огюст Шартье, Лео Бернет, Уистон Черчилль, Жан Жак Переннес (Бретанья, 1948-), Стивен Р. Кови (Солт-Лейк-Сити, 24 октября 1932 г. — Айдахо-Фолс, 16 июля 2012 г.), Джеймс Дональд, 1926 г. 21 апреля 2013 г., Азис, Италия) Матиас Гирке (Берлин, 1954-) Стив Бэкли (12 февраля 1969 г.) Джеймс Хантер (Детройт, 1955 г.) Лю Цун-Юань (773-819) Эстебан Ривера Ортис, Veterinaria Digital, Фридрих Ницше, Рабиндранат Тагоре, Сальвадор, Анастасия, 1995, Сальвадор, Эсприу, 5 (Рамон Пелегеро Санчис; Хатива 1940) Миямото МусасиЛао Цесун Бин (450-316 гг.ec) Marco Aurelio (Roma 121 — Vindobona 180) Marco Tullius CiceroArthur Conan Doyle (Edimburgo, 22 мая 1859 — Crowborough, 7 de julio de 1930) Конрад Лоренц Люсио Корнелио Сила (Roma 616 — 676 ab urbe condita) Гектор Роберту «Атауальпа Юпанки» Арчи Эдмистон Рой, профессор Кристоф Редис, Университет Йены Анонимо Йибран Дж. Гибран Леонардо да Винчи Джон Бурдон Сандерсон Холдейн (Оксфорд 1892 — Бхубанесвар 1964) Демостенес Робертон Эндрюс, 1904 г., Мюлфориг, Мартес, 16, Сэрван, Мартес, 16, 46 (1547 — 1616) Артур Хелпс (Стритэм, 10 июля 1813 г. и Лондон, 7 марта 1875 г.) Клод Бернар (Сен-Жюльен-сюр-Рон 1813 г. — Париж 1878 г.) Мариано Хосе де Ларра (Мадрид, 24 марта 1809 г., Мадрид, 13 февраля 1837 г.) HesiodoJ .Р.Р. Толкин, Дональд Портер (1953) Пол ди Модика, Стивен Ричардс Кови (Солт-Лейк-Сити, 24.10.1932 — Айдахо-Фолс, 16.07.2012) Нанду Джубани (Монистроль де Колдерс, 19.01.1971) Северо-Очоа (Луарка, 24.09.1905) — Мадрид 01.11.1993) Видал Сасун (Лондон 17.01.1928 — Лос-Анджелес 05.09.2012) Рабиндранат Тагор (Калькута, 7 мая 1861 г. и расчет 7 августа 1941 г.) Питер Фердинанд Друкер (Вена, 19.11.1909 г.) Клермонт 11/11/2005) Ферри Джозефон (Кардифф 1940) ТЕРМИНОС Рене Декарт (Ла-Хэй 31.03.1596 г. Стокгольм 11.02.1650) Генри Форд (Гринфилд 30.06.1863 г. Фэйр-лейн 07.04.1947) Антуан де Сент-Экзюпери (Лион, 29 июня 1900 г., Исла-де-Рио, 31 июля 1944 г.) Энди Таршис Филип Котлер (Чикаго, 27 мая 1931 г.) Филип Котлер (Чикаго, 27 мая 1931 г.) Марк МакКормак (Чикаго, 06 ноября / ноября 1930 г. — Нью-Йорк 16 мая / 2003) Филип Дуглас Джексон ((Deer Lodge, 17 сентября 1945 г.) Бенджамин Франклин (Бостон 17.01.1706 — Филадельфия 17.04.1790) Сэмюэл К.К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области медицины в 1976 г. Самуэль К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области экономики в 1976 г. Мануэль Мартин Ферран (Ла-Кору? 11 декабря 1940 г. — Мадрид 30 августа 2013 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. — Нью-Йорк, 16 мая 2003 г.) Проф. . Д-р Диего Джордано (Кордова, 6 ноября 1918 г. — Кордова, 11 февраля 2002 г.) Альберт Сент-Дьордьи, Премия Нобелевской премии по физиологии 1937 г. (Будапешт, 16 сентября 1893 г. — Массачусетс, 22 октября 1986 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. — Нью-Йорк, 16 мая 2003 г.) ) Алан Кертис Кей (Спрингфилд, 17 мая 1940)
Бессимптомный аспергиллез домашней птицы — Veterinaria Digital
Поиск
Контент
Все типыНовостиСтатьиБлогиСобытияКомпанииКартина неделиКорпоративная культура
Категория
Все категорииАнтибиотикиАнтиоксидантыАквакультураДезодорантДижестивыРаспространениеФерментыСобытияУправление фермойЖирыКормлениеВкусИммуностимуляторыМикробиоцидМногофункциональныеМикотоксиныПитаниеПатологияФармакологияКартинкаПтицеводствоРезерводство
Тэг
Все TagsAbdominal FatAcidosisActinobacillus suisAdditivesadenoviridaeadenovirusAflatoxinAflatoxinsAfrica-enAGP Антибиотик Рост PromotersAgrenaair sacsALAAlquerfeedAlquermold NaturalAlquernat NebsuiAlquernat YuccaAlquernat Zycoxalternative cerealsAmoniacoAMVECAJAnimal корма feedanimal additivesanimal healthanimal healthAnimal Husbandryanimal productionanimal welfareantibiotic рост promoterantibiotic свободной chickensantibioticsantibodiesAnticoccidial planantioxidantsAntiviotic свободной eggsAquacultureaquaculture lightingAquaculture productionAquaculture productionArterial hypertensionArtificial InseminationAscitesAsia-enAspergillus-enatlasatlas patology’savesuiavian diseasesavian fluAvian инфекционное bronchitisAvian инфекционно-токсический гепатоэнтерит, птичий грипп, микоплазмоз птиц, пулороз птиц, септицемия птиц, Награды, бактерии, бактерицидные бактерии, статические бактерии, сбалансированный корм, Бангкок, Бангладеш, говядина, крупный рогатый скот, биогаз, биомасса, биогаз, биогаз vetBiovet AwardsBiovet SymposiaBirdsblackhead diseaseBone fracturesBovineBovine-enbreedersbreeding sowsBroiler managementBroilersBroilersbroilersbroodinessbroody hensBursa из Fabriciusbutyratecaecal coccidiacage-freeCagescages для укладки hensCAHEcalciumcalves’ immuneCampylobacter jejuniCampylobacteriosiscapillariacaptadores де micotoxinascarbon dioxideCattle farmingCellsCentral Americachemical coccidiostatsChicken breedsChickensChileChinaCimenol RingClostridiumClostridium perfringenscobayacobayoCoccidiacoccidicidescoccidiosiscoccidiosiscoccidiostatscochlosomiasisCollaborationcolostrumcommercial утка productionconditioner pronutrientsConditioning свиньи barnconejillo де indiasConferencesConjuntiva глазное -enCorneal слой gizzardcoronaviruscovid 19cuyeCyanosis earsCystsDairy CattleDecalcificationdeep Постельные принадлежности systemDermatitis синдром свиней нефропатия, дерматит и искривление килевой кости, головная боль у телят, пищеварение у рыб, пищеварительный микоз, пищеварительная система, пищеварительный тракт, грязь eggsdiseaseDisease preventiondisease vectorsdisinfectionDisseminationDuckDuck breedsDuck eggsduck managementDuck meatDUCKSDuodenal foamEar NecrosiseditorialEggEgg DayEgg depigmentationegg layingegg productionegg qualityegg qualityeggs productioneggs transportEggsCargoSystemEggshellEggshell defectsEimeriaEimeria acervulinaEimeria tenellaEndocrine SystemEnergy savingEnteritis вызваны жира acidityEnteritis-enEnterobacteriaEnzyme deficiencyEnzymesEP2 ReceptorEquineEscherichia палочка -enEuropeeventeventosEvolutionExothermalExpositionfacilities для layingfairFami QSfarm managementfarm ventilationfarmingFatty liverfeaturedfeedfeedfeedingFeverFishfish feedfish productionFishmealFlavoringFlavoringsflufood coloringsFood safetyFood safetyFootpad dermatitisFormaldehydeFormaldehyde burnsFowlpoxfungifungicidalFusarium-enGangrenous dermatitisgarantía де calidadGas in cecagastrocnemius желудочно-кишечные симптомы гусиГенетикаГеотермальная энергияGi-OvoМизокКозье молокоХорошее качество водыЗеленый желтоккгрегат Креветки выращивают морские свинки, морские свинки, микробиота гумборогута, восприимчивость, тепловой стресс, гельминты, кровоизлияния в нижней части живота, у форели, кровоизлияния в репродуктивную систему, геморрагический энтерит, геморрагический ожирение печени, геморрагический энтерит, геморрагический ожирение печени, геморрагический энтерит, геморрагический синдром, гепатодезин, гепатит, инфекция, 9000, гепатодезинфекция, гепатодезинфекция, инфекция, гепатит, инфекция, гепатит, гепатит, инфекционные заболевания, 9000, гепатодезинфекция, гепатодезинфекция, инфекционные заболевания
Болезни домашней птицы и их лечение должны быть вашей главной заботой, если у вас есть птицефабрика.Разведение домашних животных несложно, но болезни могут испортить бизнес. Одно зараженное животное может буквально убить других животных на ферме. Поэтому очень важно выявлять все болезни и своевременно их лечить.
Изображение: pexels.com
Источник: UGC
Некоторые фермеры думают, что домашние животные страдают очень немногими болезнями, если они не контактируют с другими животными или людьми. Фактически, многие болезни могут передаваться через пищу и даже через окружающую среду на ферме. Прочтите этот пост, чтобы узнать больше о профилактике заболеваний и гигиене.
Какие болезни птицы наиболее распространены?
Птицу и других домашних животных поражают многие болезни. Ниже вы найдете краткий список наиболее распространенных и распространенных болезней птицы, их особенности, симптомы, а также методы лечения и профилактики.
Изображение: flickr.com
Источник: UGC
ЧИТАЙТЕ ТАКЖЕ : Рентабельность птицеводства в Нигерии
Что вы должны знать о маске коронавирусаКокцидиоз
Это одна из самых распространенных болезней птицы, потому что микробы, которые потому что он может жить в земле долгое время, безопасно перенося довольно тяжелые условия.Повышенная влажность — идеальная среда для этих микробов. Вы можете предотвратить заражение, поддерживая чистоту и сухость.
Заболевание передается через плохо промытые овощи и другие продукты питания, питьевую воду, а также через крыс, инфицированных домашних птиц и диких птиц. Куры подвержены этому заболеванию с 80-го дня после рождения.
Основной симптом этого заболевания — сильный понос с кровью и пеной. Птицы часто теряют способность двигаться и сидеть в одной позе с взъерошенными перьями.Состояние опасно тем, что оно практически незаметно на этапе, когда можно эффективно лечить. Вылечить его можно, добавив в корм птиц порошкообразную серу и проведя полную дезинфекцию фермы.
Болезнь Лайма: основные факты и правда об этой болезни в Великобритании Изображение: pixabay.com
Источник: UGC
Коли
Эта инфекция — еще одна распространенная болезнь, которая может поражать вашу птицефабрику. Эффективно лечить это заболевание можно с помощью антибиотиков определенного типа, назначенных ветеринаром.
Болезнь Ньюкасла
Болезнь — одна из самых опасных для домашней птицы. В группе риска куры всех возрастов. Они становятся сонливыми, теряют аппетит, у них повышается температура и возникают проблемы с дыханием. К сожалению, после того, как болезнь уже проявилась, эффективного лечения не существует. Всю зараженную птицу необходимо уложить, чтобы предотвратить дальнейшее заражение. Единственный способ борьбы с этим заболеванием — специальная вакцина.
Оспа
Оспа обычно поражает молодых птиц. От этого заболевания нет лечения, и всех зараженных птиц следует изолировать от других.Если на вашей ферме вы заболели оспой, немедленно сообщите об этом местному ветеринару. Однако профилактическая вакцинация работает намного лучше.
Птичий грипп
Это заболевание широко известно как птичий грипп, и многие люди опасаются, что они могут заразиться им от домашних или диких птиц. На самом деле эти опасения вполне обоснованы, потому что они могут повлиять на людей. Вам нужно быть очень внимательным к своему стаду, чтобы заметить первые признаки и как можно быстрее избавиться от больных.
Эти простые советы помогут вам вылечить темные локти.Первые заметные признаки включают проблемы с дыханием, изменение цвета морды больной птицы (или они могут стать синеватыми) и появление красных пятен вокруг глаз. Как только вы заметите это, вам нужно положить конец заразным птицам, уничтожить их тела и как следует продезинфицировать территорию. Вы также должны быть очень осторожны, чтобы не заразиться вирусом. К сожалению, эффективной вакцины для защиты вашей фермы не существует.
Изображение: picjumbo.com
Источник: UGC
Холера
Животные тоже страдают холерой, и это заболевание поражает кур, уток и гусей. Состояние очень опасно и вызывает высокий уровень смертности. Особенно подвержены этому заболеванию молодые цыплята до 2 месяцев. Инфекция передается через зараженную пищу и воду, инструменты и контакты с инфицированными или выздоравливающими птицами.
При заражении домашняя птица становится слабой и у нее повышается температура. Их носы и клювы покрыты пенистой слизью, а их экскременты могут содержать кровь.Лечить таких птиц категорически запрещено. Всех заболевших нужно немедленно уложить, а местность тщательно продезинфицировать. Все внутренние органы больных птиц необходимо уничтожить. При обширном некрозе тела зараженных птиц также необходимо уничтожить. Яйца можно использовать только после дезинфекции.
Лечение герпетической язвы в домашних условиях, которое вы должны попробоватьБолезнь воздушного мешка
Это бактерия, которая может быть занесена в ваш район даже дикими птицами. Во-первых, вы заметите, что ваши куры практически не могут откладывать яйца и они слабые.Затем возникнут проблемы с дыханием: чихание, кашель и так далее. Со временем их суставы опухнут. Тогда многие из них, возможно, умрут.
Самая плохая новость об этой болезни заключается в том, что она может передаваться от курицы к курице внутри яйца. Лучшая новость обо всем этом заключается в том, что бактерии можно убить с помощью антибиотиков, назначенных ветеринаром. Здоровую птицу можно защитить с помощью вакцины.
Изображение: pixabay.com
Источник: UGC
Пуллороз
Это заболевание — опасная инфекция, поражающая кур и цыплят индейки в возрасте от нескольких дней до двух недель.Птицы становятся слабыми и испытывают жажду, теряют аппетит. Некоторые из них стоят, широко расставив ноги, с закрытыми глазами. Экскременты становятся водянистыми и пенистыми. Как правило, явно больных птиц убивают сразу, и только относительно здоровых лечат антибиотиками, прописанными ветеринаром.
Болезни сельскохозяйственных животных: виды, причины, профилактикаКаннибализм
Несмотря на то, что это не инфекция, это заболевание также часто рассматривается как разновидность болезни, поскольку оно может отрицательно сказаться на вашем хозяйстве.Это вызвано слишком большим количеством птиц в одном месте, сырым и душным птичьим двором, слишком большим количеством света, проблемами с обменом веществ. Птицы разного возраста и размера, содержащиеся на одной и той же небольшой территории, могут подвергаться атакам каннибализма. Птицу, однажды попробовавшую кровь, следует держать подальше от всех, чтобы не допустить дальнейших провокаций. Каннибализм быстро исчезает после кормления птиц.
Жесткий зоб
Это состояние вызвано грубой, сухой и затхлой пищей. Ворона застревает в еде и очень сильно.Птица теряет аппетит и сидит с взъерошенными перьями. Состояние лечится путем введения в зоб от 30 до 50 мл растительного масла через зонд. Затем поверните птицу головой вниз и осторожно помассируйте зоб, пока он не станет пустым. На следующий день осторожно промойте зоба водой и только на второй день птицу можно будет съесть жидкий молочный корм.
9 болезней, связанных с водой, которые могут поразить любого. Изображение: pixabay.com
Источник: UGC
Рахит
Рахит — неинфекционное заболевание, которое возникает, если в рационе птицы не хватает витамина D.Чтобы предотвратить различные формы дефицита витаминов, добавляйте дрожжи, свежую зелень, пшеничные отруби и проростки в обычную пищу.
Отравление
Пищевые или другие отравления также относятся к болезням домашней птицы. Иногда птицы заражаются из-за неосторожной дезинфекции помещения, плохо очищенной пищи, зараженной грибком, тухлыми овощами и т. Д.
Ботулизм
Это сложное заболевание, которое может закончиться параличом всего тела, включая органы дыхания.Ваша птица просто не сможет дышать, и это приведет к летальному исходу. Заболевание вызывается токсином, который вырабатывается бактериями. Заболевание можно остановить, а действие токсина нейтрализовать, если дать птицам порцию антитоксина, полученную у ветеринара.
Кроме того, вы можете предотвратить такое заболевание, контролируя качество корма, который вы даете своим птицам, и хорошо убирая их места. Как правило, куры заражаются от мертвых тел, лежащих в пределах досягаемости, или от зараженной воды (опять же, если в воде есть что-то мертвое).
Вакцинация несушек: график, принципы и важность Изображение: pixabay.com
Источник: UGC
Бронхит
Птица тоже может болеть бронхитом. Это легко заметить, когда цыплята начинают издавать звуки, такие как чихание или храп. Со временем их глаза и носы начинают обильно слезиться. Из-за этого состояния птицы сильно страдают, и их способность откладывать яйца также сильно страдает.
Болезнь распространяется по воздуху, и единственный способ предотвратить это — вакцинация.Если некоторые из ваших цыплят уже инфицированы, найдите им теплое и сухое место, где они смогут поправиться. Некоторые свежие травы, употребляемые в пищу, могут помочь им восстановить здоровье.
Инфекционный ринит
Это опасное заболевание, вызываемое бактериями, и, к сожалению, нет вакцины, чтобы эффективно его остановить. Основные симптомы легко заметны. Головы цыплят опухают до тех пор, пока их глаза почти не закрываются. Взрослые куры перестают откладывать яйца, и из их глаз и носа текут выделения.Влага также появляется под их крыльями.
Как предотвратить инфекционное заболевание в Нигерии?Единственный способ защитить свое стадо — это предотвратить любые контакты вашей домашней птицы с другими животными. Поддержание чистоты воды и территории снизит риск заражения.
Болезнь Марека
Другая болезнь, которая может поразить вашу ферму, называется болезнью Марека. Вы заметите это сразу, потому что у инфицированной птицы по всему телу разовьются опухоли. Эффективного лечения не существует, и в большинстве случаев это пожизненное заболевание, при условии, что инфицированный цыпленок выживает.Вам нужно будет избавиться от всех зараженных, потому что вирус невероятно улавливает, и все стадо может быть поражено в кратчайшие сроки, просто вдыхая частички кожи больных птиц.
Самым эффективным профилактическим средством является вакцинация, которая проводится всем цыплятам в возрасте одного дня.
Границы | Безопасность, защитный иммунитет и способность DIVA-кандидата вакцины против грубого мутанта Salmonella Pullorum у бройлеров
Введение
Инфекционные бактерии домашней птицы Salmonella enterica subsp. enterica можно разделить на две широкие группы сероваров на основе патогенеза и биологии инфекции (EFSA, 2004). Одна группа, содержащая серовар Gallinarum biovars Pullorum и Gallinarum, вызывает тяжелое системное брюшноподобное заболевание у ограниченного круга хозяев (Barrow and Freitas Neto, 2011). Другая группа, содержащая серовар Enteritidis, вызывает желудочно-кишечные заболевания у широкого круга хозяев, включая человека. Salmonella Pullorum хорошо адаптирован к молодым цыплятам в возрасте до 3 недель и приводит к острым системным заболеваниям и высокой смертности.Во многих развивающихся странах инфекций Salmonella Pullorum среди домашней птицы являются обычным явлением, и пуллорум остается основной угрозой для птицеводства (Guo et al., 2016). Salmonella Enteritidis является причиной пандемии пищевого сальмонеллеза среди людей, отчасти потому, что он обладает уникальной способностью заражать продукты из птицы, не вызывая заметных заболеваний у инфицированных птиц (Guard-Petter, 2001). Следовательно, существует потребность в методах, которые защищают бройлеров от дня вылупления до убойного возраста от заражения Salmonella Pullorum, а также снижают заражение пищевым серотипом Salmonella Enteritidis.
Вакцинация цыплят открыла многообещающее будущее, и продолжается прогресс в разработке безопасной и эффективной вакцины против Salmonella , которая обеспечивает широкую перекрестную защиту для улучшения здоровья животных и безопасности пищевых продуктов (Heithoff et al., 2015). Salmonella Pullorum, вероятно, удастся уничтожить у домашней птицы исключительно с помощью метода испытаний и убоя для борьбы с болезнями (Всемирная организация здравоохранения животных [OIE], 2008). Серодиагностика пуллороза обычно основана на обнаружении антител против липополисахаридов Salmonella (LPS) с помощью макроскопического теста агглютинации пробирки, экспресс-теста агглютинации сыворотки (SPA), анализа цельной крови на окрашенный антиген или микро- тест агглютинации (Шивапрасад, 2000).В связи с тем, что племенные стада проходят скрининг на специфические сывороточные антитела против Salmonella LPS с использованием теста SPA (Gast, 1997), антитела, вырабатываемые после вакцинации, неотличимы от антител, вырабатываемых в ответ на инфекцию Salmonella Pullorum дикого типа. Основная цель при разработке идеальной вакцины состоит в том, чтобы она не мешала программе мониторинга сальмонеллеза. Концепция вакцин DIVA, основанная на отсутствии в вакцине хотя бы одного иммуногенного белка или антигена, но присутствующих в штамме дикого типа, уже была предложена для коммерческого использования в ветеринарии (Selke et al., 2007; Leyman et al., 2011; Román et al., 2012). Более того, способность живой вакцины выделяться и сохраняться в окружающей среде должна быть проверена, чтобы предоставить информацию для оценки неприемлемой опасности длительного выживания для окружающей среды (Leyman et al., 2012).
Необходимость удаления генов дикого типа, чтобы отличать вакцинированные штаммы от штаммов дикого типа, открывает новые возможности. В связи с этим создание новых аттенуированных вакцинных штаммов Salmonella было сосредоточено как на делеции факторов вирулентности, так и на нарушении метаболических путей, в то же время балансируя безопасность и иммуногенность (Galen and Curtiss, 2014).LPS является основным фактором вирулентности, а O -антиген является иммунодоминантным антигеном в тестах серологической диагностики. Усечение O -антигена и предотвращение его синтеза — это две стратегии ослабления Salmonella для использования в качестве вакцины DIVA (Kong et al., 2011). WaaL представляет собой мембранный фермент, участвующий в лигировании O -антигена с липидным олигосахаридом А-ядра. Наличие или отсутствие антигена О-цепи определяет, является ли ЛПС гладким или шероховатым соответственно.Мутации в гене waaL приводят к тому, что бактерии обладают грубым LPS (Pérez et al., 2008). Однако мутант с делецией waaL (такой как Salmonella Typhimurium Δ waaL ) оказался недостаточно аттенуированным (Nagy et al., 2008), и поэтому считалось, что требуется второй ген вирулентности. SpiC необходим для транслокации эффекторов SPI-2 ( Salmonella , остров патогенности 2) (Geng et al., 2014), поэтому spiC был выбран в качестве дополнительной ослабляющей делеции.
Цели настоящего исследования заключались в оценке безопасности и защитной способности штамма с двойным мутантом Salmonella Pullorum Δ spiC Δ waaL после внутримышечной инокуляции суточных бройлеров и оценка полезности этого штамма в качестве Стратегия DIVA.
Материалы и методы
Цыплята
В лаборатории было выведенобелых куриных эмбрионов линии HY, полученных из Института птицеводства Цзянсу (Китай).Цыплят проверяли на отсутствие инфекции Salmonella с помощью бактериологического исследования, как описано ниже, а также на наличие каких-либо клинических признаков кишечного заболевания. Экспериментальные группы были размещены в отдельных проволочных клетках с достаточным количеством корма и воды при температуре окружающей среды. Все экспериментальные процедуры и процедуры содержания животных были разрешены комитетами по благополучию и этике животных Университета Янчжоу (SYXK [Su] 2012–0029) и соответствовали руководящим указаниям административного комитета учреждения и комитета по этике лабораторных животных.Все лабораторные процедуры по охране труда и технике безопасности были соблюдены в ходе экспериментальной работы.
Бактериальные штаммы и развитие Salmonella Мутантный штамм Pullorum
Штамм Salmonella Pullorum S06004, первоначально выделенный от цыплят с пуллорум, имеет естественную устойчивость к налидиксовой кислоте (Nal) (Geng et al., 2014) и использовался в качестве контрольного штамма. Мутантный штамм с делецией spiC , S06004Δ spiC (Guo et al., 2016), был использован в качестве фонового штамма для конструирования мутанта LPS raw. Делецию гена waaL проводили с использованием метода одностадийной инактивации, как описано ранее (Даценко и Ваннер, 2000). Целевой ген был удален от начального до стоп-кодона, что подтверждено секвенированием. Для иммунизации цыплят использовали мутантный штамм Salmonella Pullorum S06004Δ spiC Δ waaL . В качестве контрольных штаммов использовали вирулентный штамм Salmonella Gallinarum SG9 Nal R , поставляемый Barrow (1990), и Salmonella Enteritidis F06 Nal R , выделенный от мертвых кур птицефабрики.
Экстракция ЛПС, окрашивание серебром и иммуноблот-анализ
Липополисахариды экстрагировали фенольным методом с использованием набора для экстракции LPS (iNtRON, Корея), процедура включала лизис, осаждение, очистку и ресуспендирование. Образцы ЛПС разделяли на 12% SDS-PAGE гелях (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и окрашивали с помощью набора для окрашивания серебром (Thermo Scientific, США). Вестерн-блоттинг выполняли с использованием моноклонального антитела против O9 и козьего антимышиного IgG HRP (1: 5000; Sigma-Aldrich, США).Для выявления грубого фенотипа колонии, характерного для мутантного штамма, был проведен тест на акрифлавин на слайдах (Cerdà-Cuéllar and Aragon, 2008). Вкратце, колонии 24-часовой культуры, приготовленные из вакцинного штамма на чашках с питательным агаром, смешивали с 30 микролитрами 0,2% акрифлавина на предметном стекле. Смеси вращали в течение 1 мин и наблюдали за макроскопическими признаками агглютинации.
Оценка LD 50 и колонизации органов
Для определения 50% летальной дозы (LD 50 ) группы 10-дневных цыплят инфицировали внутримышечно 10-кратными разведениями (от 10 5 до 10 10 КОЕ) S06004Δ spiC Δ waaL или S06004.За птицами наблюдали в течение 3 недель после заражения, и смертность регистрировали ежедневно для расчета значений LD 50 .
Бактериальная устойчивость и клиренс были проанализированы для определения количества штамма живой вакцины путем подсчета Nal-резистентных Salmonella на грамм печени или селезенки. Сорок птенцов, полученных в день вылупления, случайным образом разделили на две равные группы. Вакцинированной группе внутримышечно вводили 1 × 10 7 КОЕ живой вакцины, тогда как контрольной группе вводили 100 мкл PBS.После этого через 2, 7, 14 и 21 день после вакцинации печень и селезенку получали от каждой группы из пяти птиц с использованием асептических методов, взвешивали и затем гомогенизировали. Разведения гомогената инкубировали на селективном агаре XLT4 (Difco, США), содержащем 100 мкг / мл Nal, при 37 ° C и подсчитывали полученные колоний Salmonella .
Эксперименты по вакцинации
Иммунизация и защита от Salmonella Pullorum Challenge
Сорокодневных цыплят были разделены на две группы ( n = 20 / группа), обозначенные как группа A (невакцинированный контроль) и группа B (вакцинированная), чтобы оценить защитную эффективность мутанта Salmonella Pullorum. после однократной внутримышечной инъекции.Этим двум группам суточных цыплят вводили 100 мкл PBS (pH 7,2) или PBS, содержащего ∼1 × 10 7 КОЕ мутантного штамма S06004Δ spiC Δ waaL . Животным внутримышечно вводили 10 9 КОЕ вирулентной Salmonella Pullorum через 14 дней после иммунизации (dpi) (Guo et al., 2016). Смертельные случаи и клинические симптомы регистрировались ежедневно в течение следующих 2 недель. В конце этого периода всех выживших цыплят забивали. Клинические баллы определялись и записывались с использованием системы, описанной нами ранее Guo et al.(2016). Органы (печень, селезенка и слепая кишка) собирали у каждой группы из пяти птиц в асептических условиях, взвешивали и гомогенизировали для проверки наличия штамма контрольного заражения. Разведения гомогената готовили в стерильном PBS (pH 7,2) и высевали на селективный агар XLT4 (Difco, США), содержащий 100 мкг / мл Nal.
Перекрестная защита от гомологичного серотипа
Четыре группы 20-суточных цыплят были вакцинированы S06004Δ spiC Δ waaL , как описано в разделе «Иммунизация и защита против Salmonella Pullorum Challenge».В возрасте 50 дней цыплятам внутримышечно вводили 10 9 КОЕ вирулентного штамма Salmonella Gallinarum SG9 или 10 9 КОЕ Salmonella Enteritidis F06. Смертность регистрировалась в течение 2 недель.
Защита от Salmonella Enteritidis, индуцированная вакцинным штаммом, была оценена путем анализа способности контрольного штамма колонизировать желудочно-кишечный тракт, печень и селезенку вакцинированных и контрольных цыплят.Через четырнадцать дней после заражения пять птиц из каждой группы были умерщвлены и приготовлены гомогенаты тканей. Соответствующие разведения гомогенатов высевали на чашки с агаром XLT4, содержащие 100 мкг / мл Nal, для подсчета Salmonella Enteritidis, присутствующих в каждой ткани.
Производство антител и анализ стимуляции лимфоцитов
Непрямой метод ELISA с использованием убитых нагреванием целых бактерий Salmonella Pullorum в качестве покрывающего антигена применяли для количественного определения IgG в сыворотке, как описано ранее (Guo et al., 2016). Вкратце, бактериальный антиген наносили на 96-луночный планшет и инкубировали в течение ночи при 4 ° C. После блокировки образцы сыворотки, собранные на 7, 14, 21 и 28 дни, разбавляли и добавляли в лунки. Лунки инкубировали с разведением 1: 5000 козьих вторичных антител против куриного IgG, конъюгированных с пероксидазой хрена (Sigma – Aldrich, США), в течение 1 часа. Поглощение при 405 нм измеряли с помощью автоматического считывающего устройства для микропланшетов (Synergy 2, BioTek, США) после остановки реакции с помощью 2 М H 2 SO 4 .Полученные значения оптической плотности (OD) использовали для расчета скорректированных значений E по следующей формуле: E -значение = [OD (образец) — OD (отрицательный контроль) / OD (положительный контроль) — OD ( отрицательный контроль)]. Чтобы оценить влияние вакцины-кандидата на клеточно-опосредованный иммунный (CMI) ответ после иммунизации, на 21 день проводили анализ пролиферации периферических лимфоцитов, как описано ранее (Rana and Kulshreshtha, 2006).
Возможность серодиагностики на основе DIVA
Тест SPA был использован для оценки способности DIVA вакцины-кандидата S06004Δ spiC Δ waaL (Gast, 1997; Lalsiamthara et al., 2015). Коммерчески доступный планшетный тест Антигены Salmonella Pullorum были получены от Zhonghai Biotech (Пекин, Китай). Суточных цыплят иммунизировали внутримышечно вакцинным штаммом или мутантом S06004Δ spiC (фенотип гладкого LPS). Сыворотку готовили на 7, 14, 21 и 28 дни путем сбора крови путем пункции сердца и предоставления ей возможности коагулировать в течение 3 ч при комнатной температуре перед сбором фракции сыворотки. Образцы сыворотки вакцинированных птиц (30 мкл) смешивали с равным объемом стандартного тестового антигена SPA и наблюдали реакцию агглютинации.
Оценка экологической безопасности
Чувствительность мутанта S06004Δ spiC Δ waaL к ультрафиолетовому свету и различным дезинфицирующим средствам оценивали, как описано (Leyman et al., 2012; Han et al., 2014), с небольшими изменениями. Бактерии выращивали до OD 600 = 1,0 при 37 ° C при встряхивании и разбавляли в PBS до 10 9 КОЕ / мл. Затем один миллилитр суспензии переносили в стерильную чашку Петри и подвергали воздействию ультрафиолетового излучения (PHILIPS, UV-C: 254 нм, 30 Вт, расстояние: 45 см) в течение 1 мин.Для устойчивости к окислению и щелочам каждую суспензию инкубировали в присутствии стрессоров при комнатной температуре: 100 мкМ перекиси водорода в течение 5 минут или 12,5 мМ гидроксида натрия (NaOH) в течение 5 минут. Чувствительность штаммов к порошку пероксимоносульфата, который является активным ингредиентом в выбранном дезинфицирующем средстве (DuPont TM Virkon ® S, Шэньчжэнь, Китай), анализировали методом микроразбавления с использованием серийных двукратных разведений. Наконец, 10-кратные разведения наносили на чашки LB для количественного определения жизнеспособных бактерий.Эксперимент проводился трижды.
Статистический анализ
Статистический анализ выполнен с помощью GraphPad Prism 5 (GraphPad Software, США). Для определения статистических различий между несколькими экспериментальными группами использовался односторонний дисперсионный анализ с последующими множественными сравнительными тестами Даннета. P <0,05 считалось статистически значимым.
Результаты
Мутант waaL демонстрирует усеченный ЛПС без области O -Антигена
Чтобы подтвердить, что биосинтез O -антигена был затронут, профили LPS дикого типа и мутантных штаммов сравнивали с использованием окрашивания серебром препаратов LPS.Как показано на Фигуре 1A, LPS из штамма дикого типа демонстрировали лестничный узор с различной длиной O -полисахаридных повторов, тогда как мутант с геном waaL имел грубую структуру LPS типа A (Ra). Кроме того, вестерн-блоттинг подтвердил отсутствие реактивности мутантного ЛПС waaL с моноклональным антителом против O9, что указывает на отсутствие в ЛПС антигена O (рис. 1В). Штамм дикого типа и мутантный штамм waaL можно было отличить друг от друга с помощью теста скольжения с акрифлавином.Мутантный штамм демонстрировал грубый фенотип, тогда как штамм дикого типа демонстрировал гладкий фенотип, поскольку не вызывал агглютинации (рис. 1С).
РИСУНОК 1. Фенотипическая характеристика ЛПС у мутантных штаммов и штаммов дикого типа. (A) SDS-PAGE ЛПС, проанализированного окрашиванием серебром. (B) Вестерн-блоттинг-анализ ЛПС с использованием моноклонального антитела против O9. (C) Мутантный штамм имеет грубый внешний вид с использованием теста агглютинации акрифлавина. (D) Схематическое изображение молекулы ЛПС Salmonella Pullorum (липид A, полисахариды ядра и O -антиген).
Определение затухания Δ spiC Δ waaL Деформация
Чтобы подтвердить безопасность мутантного штамма в качестве кандидата на живую вакцину, вирулентность родительских и мутантных штаммов была оценена на однодневных белых цыплятах линии HY. LD 50 S06004Δ spiC Δ waaL была примерно в 400 раз выше, чем у родительского штамма при внутримышечной инфекции (Таблица 1).
ТАБЛИЦА 1. Характеристики Salmonella мутантов Pullorum.
Колонизация и постоянство органов
Результаты персистенции бактерий и их выведения из органов показаны на рисунке 2. Бактериологический анализ показал, что инокуляция мутантным штаммом привела к высокому уровню колонизации внутренних органов через 2 дня после вакцинации и персистенции в течение примерно 2 недель, что позволяет предположить, что вакцина штамм сохраняла способность вторгаться в хозяина и стимулировать иммунный ответ.В целом, однако, устойчивость напряжения постепенно снижалась в ходе эксперимента. Все образцы, взятые через 21 день после инокуляции, были отрицательными, что указывает на то, что мутантный штамм эффективно очищен.
РИСУНОК 2. Колонизация и персистентность вакцинного штамма в печени и селезенке после инокуляции суточных цыплят бактериальными клетками 10 7 КОЕ. Значения представлены как log 10 КОЕ / г образца. Отрицательные образцы показаны как 0 КОЕ / г; все образцы из контрольной группы были отрицательными.
Эффективность защиты от вирулентных вирусов Salmonella Pullorum Challenge
Цыплят, которым была привита вакцина, показали значительно более высокую защиту от заражения Salmonella Pullorum по сравнению с неиммунизированными цыплятами. Смертности в иммунизированной группе не наблюдалось, в то время как 16 из 20 бройлеров погибли в невакцинированной группе (рис. 3А). После заражения средняя оценка патологии вакцинированной группы и контрольной группы составляла 1.10 ± 1,77 и 4,70 ± 0,66, соответственно, что указывает на то, что иммунизированные цыплята получили значительно более низкие средние оценки, чем контрольные. У вакцинированных птиц также наблюдалось значительное снижение количества контрольных бактерий в органах (таблица 2).
РИСУНОК 3. Защитная способность грубого мутанта против вирулентного Salmonella enterica серовар Gallinarum biovar Pullorum и заражение Gallinarum. При четырнадцати точках на дюйм цыплятам из каждой группы внутримышечно вводили 1 × 10 9 КОЕ дикого типа Salmonella Pullorum S06004 (A) или вирулентного Salmonella Gallinarum SG9 (B) .Защиту выражали в процентах выживаемости после заражения ( ∗∗∗ P <0,001).
ТАБЛИЦА 2. Извлечение Salmonella из различных органов цыплят, вакцинированных мутантным штаммом, или неиммунизированных контрольных цыплят, впоследствии зараженных вирулентной сальмонеллой .
Перекрестная защита против вирулентных Salmonella Gallinarum или Salmonella Enteritidis Challenge
Чтобы оценить перекрестный защитный эффект живой вакцины, вакцинированных цыплят заражали вирулентным штаммом Salmonella Gallinarum SG9 или штаммом Salmonella Enteritidis F06.После заражения вирулентным SG9 ни один из цыплят не умер в вакцинированной группе, тогда как только два цыпленка выжили в невакцинированной группе (рис. 3B). Бактериологический анализ тканей вакцинированных птиц после заражения вирулентным вирусом Salmonella Enteritidis показал, что штамм дикого типа не может быть обнаружен ни в системных органах, ни в слепой кишке; этого не было в контрольной группе (таблица 2).
Гуморальный и клеточный иммунный ответ, создаваемый вакциной-кандидатом
Статистический анализ показал значительную разницу в гуморальном и клеточном иммунном ответе у цыплят, иммунизированных вакциной, по сравнению с контрольными животными.Уровни сывороточного IgG были значительно выше в каждый момент времени после иммунизации в экспериментальной группе (рис. 4). У вакцинированных цыплят уровень пролиферативного ответа лимфоцитов, обозначенный индексом стимуляции (SI), был значительно выше по сравнению с контрольными цыплятами (Рисунок 4).
РИСУНОК 4. Уровни гуморальных и клеточных иммунных ответов у вакцинированных цыплят по сравнению с контрольными цыплятами. Сывороточные ответы антител IgG против живого вакцинного штамма, измеренные с помощью непрямого ELISA.Звездочки указывают на значительную разницу между иммунизированной и контрольной группами с PBS ( ∗ P <0,05; ∗∗ P <0,01). Индекс стимуляции реакций стимуляции лимфоцитов с использованием растворимых антигенов у иммунизированных цыплят через 3 недели после вакцинации. Звездочки указывают на значительную разницу по сравнению с контрольной группой PBS ( * P <0,05).
Дифференциация сывороточных антител к Salmonella Pullorum
Антитела к Salmonella Pullorum часто выявляются с помощью теста SPA с использованием стандартного антигена.Сыворотка, полученная от вакцинированных цыплят S06004Δ spiC Δ waaL в различные интервалы времени, была идентифицирована как SPA-отрицательная после прививки (фиг. 5). Однако цыплята были идентифицированы как положительные в группе, вакцинированной штаммом spiC . В целом живая вакцина продемонстрировала очевидную способность DIVA, которая может быть чрезвычайно полезной в программе борьбы с сальмонеллезом.
РИСУНОК 5. Способность DIVA на основе теста агглютинации сыворотки.Сыворотка , собранная на 7, 14, 21 и 28 дни, была протестирована на реактивность по отношению к стандартному антигену Salmonella Pullorum. Цыплята контрольной группы S06004Δ spiC показали сильную реакцию агглютинации (+ / ++) на 21 и 28 дни после инокуляции.
Мутантный штамм проявляет повышенную чувствительность к стрессу окружающей среды
Высокая чувствительность к УФ-излучению была продемонстрирована как для штаммов вакцины дикого типа, так и для ослабленных вакцин, при этом ни в одном из них не было клеток, выживших после облучения УФ-С.Что касается окислительного стресса, процент выживания мутантного штамма упал примерно на 84,5%, и они продемонстрировали заметно более высокую чувствительность к перекиси водорода, чем клетки дикого типа (48,8%) (рис. 6). Штамм с дефицитом ЛПС был очень чувствителен к щелочной обработке по сравнению с соответствующим штаммом дикого типа (Фиг.6). Анализ минимальной бактерицидной концентрации показал, что грубый мутант был намного более чувствителен к убивающим эффектам порошка пероксимоносульфата соединения, чем штамм дикого типа, со значительным сокращением количества выживших клеток в некотором диапазоне концентраций (таблица 3).Следовательно, живая вакцина-кандидат не могла сохраняться в неблагоприятных условиях, что позволяет предположить, что ее можно легко удалить из окружающей среды.
РИСУНОК 6. Показатели выживаемости мутантных штаммов при различных стрессах окружающей среды. Чувствительность мутантного штамма Salmonella Pullorum и его родительского штамма к перекиси водорода (100 мкМ в течение 5 минут) и 12,5 мМ NaOH в течение 5 минут. Данные представляют собой средние значения и стандартные отклонения трех экспериментов ( ∗∗∗ P <0.001).
ТАБЛИЦА 3. Чувствительность мутантного штамма Salmonella Pullorum к порошку пероксимоносульфата.
Обсуждение
Salmonella Pullorum вызывает вспышки среди домашних птиц, что приводит к высокой заболеваемости и смертности цыплят (Xiong et al., 2016). Вакцинация не является панацеей, но всегда должна использоваться как часть комплексной программы борьбы. Живые аттенуированные вакцины широко тестировались на домашней птице, а также на мышах, хотя зарегистрировано и коммерчески доступно только несколько штаммов Salmonella для использования в домашней птице (Barrow, 2007).В идеале вакцина, используемая для борьбы с инфекцией Salmonella , должна быть безопасной, иметь перекрестную защиту, четко определяться и вызывать клеточный иммунитет (Desin et al., 2013).
Генетическая модификация вакцинного штамма Salmonella направлена на снижение риска сохранения или распространения в тканях хозяина и в окружающей среде, в то же время вызывая эффективный иммунный ответ. Двойные мутации, введенные в бактерии, могут привести к созданию высокоаттенуированного и безопасного вакцинного штамма и, таким образом, снизить риск реверсии путем приобретения генов посредством горизонтального переноса (Van Immerseel et al., 2005). O -антиген обеспечивает важные элементы для серологического различия и играет непосредственную роль в вирулентности, такой как инвазия, колонизация и устойчивость. Известно, что белок WaaL участвует в лигировании O -антигена с липидным олигосахаридом A-core (Kaniuk et al., 2004). Мутант waaL в нашем вакцинном штамме продуцирует грубый LPS, лишенный O -антигенных повторяющихся единиц (рис. 1). SPI-2 T3SS (система секреции типа III) участвует в предотвращении или устойчивости к механизмам уничтожения макрофагов, SpiC является частью трехбелкового регуляторного комплекса, который функционирует в пределах Salmonella и обеспечивает переключение с секреции белка транслокона на транслокацию эффектора. (Фигейра и Холден, 2012).Из-за этой центральной роли одиночная делеция гена spiC приводит к значительному ослаблению у Salmonella Pullorum. Наши результаты демонстрируют, что двойной мутант S06004Δ spiC Δ waaL был высоко авирулентным у суточных цыплят, поскольку он не мог вызывать смертность даже при высокой бактериальной нагрузке, использованной для вакцинации.
Чувствительность бактерий к разным дезинфицирующим средствам является важным показателем приспособленности вакцинного штамма к выживанию в окружающей среде (Leyman et al., 2012). ЛПС играет важную роль в механизмах защиты бактерий от антимикробных веществ (Liu et al., 2014). O -антиген представляет собой характерный полисахарид самого внешнего компонента внешней мембраны клеточной стенки грамотрицательных бактерий. Присутствие O -полисахарида в молекулах LPS может препятствовать достижению антимикробными веществами их участков связывания в клеточной стенке, что приводит к повышенной толерантности и выживаемости. Разработанный нами мутантный штамм очень чувствителен к различным стрессам окружающей среды, что указывает на то, что живая вакцина-кандидат, вероятно, не сможет сохраниться в неблагоприятных условиях и будет легко удалена из окружающей среды.В дополнение к этому, вакцинный штамм был исключен из бройлеров до убойного возраста, что показало хороший профиль безопасности. Эти результаты показывают, что вакцина-кандидат достаточно безопасна для цыплят.
Помимо безопасности, важна также эффективность вакцины. Гуморальные и клеточные иммунные ответы, индуцированные вакциной Salmonella , играют важную роль в предотвращении инфекции (Penha Filho et al., 2012). Измерение уровней специфических антител Salmonella используется для мониторинга гуморальных иммунных ответов.У цыплят из иммунизированной группы уровень сывороточного IgG был значительно выше, чем у цыплят из контрольной группы. Было показано, что роль CMI в устойчивости Salmonella связана как с приобретенным, так и с врожденным иммунным ответом. Кроме того, усиленный CMI может оказаться полезным для защиты видов птиц от этих внутриклеточных бактериальных инфекций (Babu et al., 2003). Измерение CMI у вакцинированных птиц проводилось для исследования влияния вакцины на пролиферацию периферических лимфоцитов.В этом исследовании живая вакцина была эффективной в увеличении пролиферации периферических лимфоцитов в ответ на растворимый антиген Salmonella Pullorum. В целом, вакцинный штамм вызывал устойчивый гуморальный иммунный ответ, а также эффективный ответ CMI.
Salmonella Pullorum, Salmonella Gallinarum и Salmonella Enteritidis — все они относятся к Salmonella серогруппы D, поэтому следует ожидать перекрестной защиты вакцины.Бактериальные мутанты с усеченным ЛПС, такие как мутант, используемый здесь, могут иметь потенциал для использования в качестве вакцины, которая генерирует перекрестный защитный иммунитет к другим сероварам (Nagy et al., 2008; Kong et al., 2011; Leyman et al. , 2011). Грубый штамм Salmonella Gallinarum 9R использовался в качестве вакцины для защиты цыплят от птичьего тифа. Помимо борьбы с брюшным тифом домашней птицы, вакцина SG 9R использовалась в нескольких странах в качестве дополнительного инструмента для борьбы с Salmonella Enteritidis в коммерческих стадах несушек (Wigley, 2017).Недавно было высказано предположение, что грубые мутанты обеспечивают лучшую доступность липида А и ядерных антигенов, в то же время они способствуют перефокусировке иммунного ответа на белки внешней мембраны (Bearson et al., 2016; Liu et al., 2016) . Поэтому было проведено исследование перекрестной защиты для изучения способности вакцины-кандидата от грубой вакцины против Salmonella Pullorum на перекрестный иммунитет. Мутантный штамм был способен обеспечивать перекрестную защиту после заражения Salmonella Gallinarum дикого типа за счет снижения смертности и с Salmonella Enteritidis дикого типа за счет предотвращения колонизации.Поскольку в сообществе домашней птицы имеется более одной серогруппы Salmonella , мы будем оценивать перекрестный защитный иммунитет и эффективность защиты против гетерологичного серотипа Salmonella , такого как Salmonella Typhimurium и Salmonella Infantis, в будущих работах.
Основой для успешной борьбы с инфекцией Salmonella Pullorum у домашней птицы являются надлежащие методы ведения сельского хозяйства и гигиены, а также тестирование и удаление положительных стад из популяций.Когда вакцинация используется в программах контроля Salmonella , возможные помехи в стандартных серологических методах обнаружения Salmonella считаются серьезным недостатком, поскольку иммунизированные животные вырабатывают антитела против вакцинного штамма, которые нельзя отличить серологическими тестами от животных, инфицированных вирусом. штаммы дикого типа (Adriaensen et al., 2007). Успех вакцины DIVA на основе LPS ( Salmonella, Gallinarum 9R) в борьбе с брюшным тифом и паратифом у птиц показал, что живые аттенуированные, но различимые бактериальные штаммы являются свидетельством продвижения вперед (Silva et al., 1981). Salmonella Gallinarum 9R является мутацией в гене rfaJ и приводит к грубому фенотипу LPS из-за дефектной боковой цепи O -антигена (Kwon and Cho, 2011). Одно из самых больших преимуществ использования вакцины 9R состоит в том, что она дает хорошую защиту и не мешает тестам, используемым для борьбы с пуллорум-брюшным тифом. В настоящем исследовании мутант гена waaL продемонстрировал усеченный ЛПС, лишенный основного поверхностного антигена, аналогичный Salmonella Gallinarum 9R.Серологические результаты, полученные от вакцинированных птиц, были отрицательными, однако образцы были положительными на животных, инфицированных диким типом. Наши результаты показывают, что мутантный штамм S06004Δ spiC Δ waaL был способен стимулировать гуморальный иммунный ответ DIVA у кур и показал удовлетворительные результаты в серологических тестах в контрольной программе Salmonella .
Таким образом, мы продемонстрировали, что приблизительная аттенуированная вакцина-кандидат от Salmonella Pullorum имеет характеристики, желательные для вакцины, включая аттенуацию, иммуногенность и свойство DIVA.Таким образом, этот мутантный штамм может быть эффективной вакциной для борьбы с инфекцией Salmonella у домашней птицы. Необходимы дальнейшие усилия для определения эффективности вакцины в полевых испытаниях и разработки эффективной стратегии борьбы с сальмонеллезом.
Авторские взносы
XJ, SG и RG разработали и разработали исследование. ZP, XC и QL проводили эксперименты. XF провела сбор образцов. RG, YJ и SZ проводили эксперименты на животных. RG и YJ провели статистический анализ.РГ и З.Л. составили рукопись. XJ завершил рукопись. Все авторы прочитали и одобрили окончательную версию рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана ключевыми проектами Национального фонда естественных наук Китая (31230070, 31320103907), Специального фонда агро-научных исследований в общественных интересах (201403054), Китайского научного фонда высоких технологий (программа 863, 2011AA10A212), а также фонд отличных докторских диссертаций Университета Янчжоу, программа, предоставленная для научных инновационных исследований выпускников колледжей в провинции Цзянсу (KYLX15_1384).Финансирующие органы не играли никакой роли в дизайне исследования, в сборе, анализе или интерпретации данных, в написании отчета или в решении представить статью для публикации.
Список литературы
Adriaensen, C., De Greve, H., Tian, J. Q., De Craeye, S., Gubbels, E., Eeckhaut, V., et al. (2007). Живая вакцина Salmonella enterica серовара Enteritidis позволяет проводить серологическое различие между вакцинированными и инфицированными животными. Заражение. Иммун. 75, 2461–2468.DOI: 10.1128 / IAI.01357-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бабу У., Скотт М., Майерс М. Дж., Окамура М., Гейнс Д., Янси Х. Ф. и др. (2003). Влияние живой аттенуированной и убитой вакцины Salmonella на Т-лимфоцитарный иммунитет кур-несушек. Вет. Иммунол. Immunopathol. 91, 39–44. DOI: 10.1016 / S0165-2427 (02) 00265-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барроу, П.А. (1990). Иммунитет к экспериментальному тифу птиц у кур, индуцированный вылеченным плазмидой вирулентностью производным Salmonella Gallinarum. Заражение. Иммун. 58, 2283–2288.
PubMed Аннотация | Google Scholar
Барроу, П. А., Фрейтас Нето, О. К. (2011). Болезнь Pullorum и тиф домашней птицы — новые мысли о старых болезнях: обзор. Avian Pathol. 40, 1–13. DOI: 10.1080 / 03079457.2010.542575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Серда-Куэльяр, М., и Арагон, В. (2008). Резистентность в сыворотке крови Haemophilus parasuis связана с системным заболеванием свиней. Вет. J. 175, 384–389. DOI: 10.1016 / j.tvjl.2007.01.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даценко К. А., Ваннер Б. Л. (2000). Одностадийная инактивация хромосомных генов в Escherichia coli K-12 с использованием продуктов ПЦР. Proc. Natl. Акад. Sci. США 97, 6640–6645. DOI: 10.1073 / pnas.120163297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
EFSA (2004 г.).Заключение научной группы по биологическим опасностям на запрос комиссии, связанный с использованием вакцин для борьбы с Salmonella в птицеводстве. EFSA J. 114, 1–74.
Фигейра Р., Холден Д. У. (2012). Функции эффекторов системы секреции типа III острова патогенности Salmonella (SPI-2). Микробиология 158, 1147–1161. DOI: 10.1099 / mic.0.058115-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гэн, С., Цзяо, X., Барроу, П., Пан, З., и Чен, X. (2014). Детерминанты вирулентности Salmonella Gallinarum biovar Pullorum, идентифицированные с помощью сигнатурно-меченого мутагенеза, и мутант spiC в качестве потенциальной живой аттенуированной вакцины. Вет. Microbiol. 168, 388–394. DOI: 10.1016 / j.vetmic.2013.11.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Guard-Petter, J. (2001). Курица, яйцо и сальмонелл и энтеритидов. Environ. Microbiol. 3, 421–430. DOI: 10.1046 / j.1462-2920.2001.00213.x
CrossRef Полный текст | Google Scholar
Го, Р., Гэн, С., Цзяо, Х., Пан, З., Чен, X., и Цзяо, X. (2016). Оценка защитной эффективности новой инактивированной вакцины Salmonella Pullorum Ghost против вирулентного заражения цыплят. Вет. Иммунол. Immunopathol. 173, 27–33. DOI: 10.1016 / j.vetimm.2016.03.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Ю., Han, X., Wang, S., Meng, Q., Zhang, Y., Ding, C., et al. (2014). Ген waaL участвует в синтезе липополисахаридов и играет роль в бактериальном патогенезе птичьего патогена Escherichia coli. Вет. Microbiol. 172, 486–491. DOI: 10.1016 / j.vetmic.2014.05.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейтофф Д. М., Хаус Дж. К., Томсон П. К. и Махан М. Дж. (2015). Разработка вакцины перекрестной защиты Salmonella для систем животноводства. Вакцина 33, 100–107. DOI: 10.1016 / j.vaccine.2014.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канюк, Н.А., Виноградов, Э., Уитфилд, К. (2004). Исследование структурных требований к коровому акцептору липополисахарида для лигирования О-антигенов в роде Salmonella : «лигаза» WaaL не является единственным определяющим фактором специфичности акцептора. J. Biol. Chem. 279, 36470–36480. DOI: 10.1074 / jbc.M401366200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kong, Q., Янг, Дж., Лю, К., Аламури, П., Роланд, К. Л., и Кертисс, Р. III (2011). Влияние делеции генов, участвующих в липополисахаридном ядре и синтезе О-антигена, на вирулентность и иммуногенность Salmonella enterica серовара Typhimurium. Заражение. Иммун. 79, 4227–4239. DOI: 10.1128 / IAI.05398-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лалсиамтхара, Дж., Гогиа, Н., Госвами, Т. К., Сингх, Р. К., и Чаудхури, П. (2015). Промежуточный грубый Brucella abortus S19Δ на мутант является активным DIVA, безопасным для беременных морских свинок и обеспечивает защиту мышей. Vaccine 33, 2577–2583. DOI: 10.1016 / j.vaccine.2015.04.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лейман, Б., Бойен, Ф., Ван Парис, А., Вербругге, Э., Хезебрук, Ф., и Пасманс, Ф. (2011). Salmonella Мутации Typhimurium LPS для использования в вакцинах, позволяющих дифференцировать инфицированных и вакцинированных свиней. Vaccine 29, 3679–3685. DOI: 10.1016 / j.vaccine.2011.03.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лейман, Б., Boyen, F., Van Parys, A., Verbrugghe, E., Haesebrouck, F., and Pasmans, F. (2012). Решение проблемы экологической выживаемости живых вакцин против Salmonella Typhimurium в окружающей среде: делеция гена lon . Res. Вет. Sci. 93, 1168–1172. DOI: 10.1016 / j.rvsc.2012.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Б., Книрель Ю. А., Фенг Л., Перепелов А. В., Сенченкова С. Н., Ривз П. Р. и др. (2014). Структурное разнообразие антигенов Salmonella O и его генетические основы. FEMS Microbiol. Ред. 38, 56–89. DOI: 10.1111 / 1574-6976.12034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, К., Лю, К., Чжао, X., Лю, Т., И, Дж., Лян, К. и др. (2016). Иммуногенность и эффективность перекрестной защиты, индуцированные белками внешней мембраны из мутантов Salmonella Typhimurium с усеченным LPS у мышей. Внутр. J. Mol. Sci. 17: 416. DOI: 10.3390 / ijms17030416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Надь, Г., Palkovics, T., Otto, A., Kusch, H., Kocsis, B., Dobrindt, U., et al. (2008). «Мягко грубо»: вакцинный потенциал мутанта регулирующего липополисахарида Salmonella enterica . J. Infect. Дис. 198, 1699–1706. DOI: 10.1086 / 593069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пенья Филхо, Р. А., Моура, Б. С., де Алмейда, А. М., Монтасье, Х. Дж., Барроу, П. А., и Беркьери, А. мл. (2012). Гуморальный и клеточный иммунный ответ, вызванный различными программами вакцинации до и после заражения цыплятами Salmonella Enteritidis. Vaccine 30, 7637–7643. DOI: 10.1016 / j.vaccine.2012.10.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перес, Дж. М., МакГарри, М. А., Марольда, К. Л., и Вальвано, М. А. (2008). Функциональный анализ большой периплазматической петли лигазы О-антигена WaaL Escherichia coli K-12. Мол. Microbiol. 70, 1424–1440. DOI: 10.1111 / j.1365-2958.2008.06490.x
PubMed Аннотация | CrossRef Полный текст |
| Пуллороз (пуллороз, птичий тиф, брюшной тиф, белая бактериальная диарея) — острое инфекционное заболевание кур и индюшат в возрасте до 2 недель и взрослой птицы.Он характеризуется поражением желудочно-кишечного тракта у молодых животных, а у взрослой птицы протекает бессимптомно и сопровождается деформацией и перерождением фолликулов яичников. Этиология. Возбудитель пуллороза — грамотрицательные, неподвижные, споры и капсулы, не образующие бактерий Sal. pullorum — галлинарум. Возбудитель хранится в подстилке более 100 дней, в воде более 200 дней, в почве 14 месяцев. Нагревание до 60 ° C нейтрализует возбудителя за 30 минут, закипание через 1 минуту. Эпизоотология. Паллороз поражает кур и индюшат, как правило, в первые дни жизни, но также может заболеть в возрасте 3-4 недель. Источником возбудителя инфекции являются куры-носители. Они выделяют возбудителя с яйцом, а при поражении кишечника с пометом. Еще один важный источник инфекции — цыплята, которые еще инфицированы в яйце. Заражение происходит в основном алиментарно и трансовариально, может быть аэрогенным, а также возбудитель может передаваться курам от больных петухов во время спаривания. Эпизоотия брюшного тифа обычно наблюдается у взрослых птиц, чаще у новичков, откладывающих яйца, но могут болеть как старые, так и молодые птицы. Летальность при пуллорозе составляет 50-70%. Патогенез. Возбудитель, попав в организм, локализуется на слизистой оболочке слепых отростков, вызывая воспалительные и дистрофические изменения. Впоследствии, проникая в кровеносную систему, он поражает печень, селезенку, вызывая образование очагов некроза. Симптомы и течение.Инкубационный период у кур длится 1-6 дней, у взрослой птицы 4-5 дней. У цыплят, инфицированных во время эмбрионального развития, признаки заболевания появляются в первые сутки вылупления (появляется диарея). Если цыплята заражаются в инкубаторе или птичнике, то они заболевают на 3-5 день после вылупления. У молодых животных различают острое, подострое и хроническое течение пуллороза, а у взрослых птиц — хроническое и бессимптомное. В остром течении болезни цыплята плохо едят, вялые, голова втянута, крылья опущены.Температура тела повышается до 43-440С, появляется обильный понос. Испражнения сначала мягкие, вязкие, затем становятся жидкими, пенистыми, меловыми. Иногда стул желтоватый и даже с кровянистым оттенком. Пушка вокруг клоаки загрязнена фекалиями и слипается, при высыхании фекалий анальное отверстие закрывается, что затрудняет изоляцию подстилки. Это вызывает интоксикацию, позже — гибель цыплят. Цыплята обычно погибают в течение 2-3 дней.Подострое и хроническое течение болезни чаще наблюдается у цыплят 20-дневного возраста.У молодых цыплят и взрослых цыплят заболевание протекает хронически в течение месяцев и даже лет. Патологические изменения. При вскрытии павших цыплят обнаруживают неразрушенный желточный мешок, скопление каловых масс в слепой кишке и выгребной яме, очаги некроза в печени, миокарде и легких, а также катаральный энтерит. У взрослых цыплят выявляется воспаление яичников и деформация желточных фолликулов. Диагностика. Для прижизненной диагностики хронического пуллороза у взрослых птиц используют ККРА и ККРНГА.Диагноз считается установленным, когда возбудитель выделен из материала и проведена его идентификация. Пуллороз следует дифференцировать от сальмонеллеза, эшерихиоза, пастереллеза, аспергиллеза, эимериоза. Лечение. Для лечения используются антибактериальные препараты после предварительного определения чувствительности к ним возбудителя. Меры профилактики и борьбы. В благополучных хозяйствах не реже 1 раза в месяц проводится бактериологическое исследование на наличие возбудителя пуллороза 30 замороженных эмбрионов.Взрослая племенная птица и весь ремонтный молодняк племенного стада подвергаются серологическому исследованию в следующие сроки. При выделении серопозитивной птицы ее удаляют из стада. При постановке диагноза птицефабрика объявляется нефункциональной и вводятся ограничения с последующим запретом на экспорт яиц от серопозитивных птиц, а также инкубация яиц от кур неблагополучных птичников. Если выявляется положительно реактивный молодняк, всю птицу неблагополучного птичника выращивают на мясных условиях и передают на убой. Ограничения с хозяйства снимаются после принятия организационных, экономических, ветеринарных, санитарных и противоэпизоотических мероприятий по устранению пуллороза, отсутствия клинических и патологических признаков у птиц и отрицательных результатов бактериологического исследования (замороженные эмбрионы, трупы). |
|