Орхидеи способ размножения: Как размножить орхидею фаленопсис в домашних условиях. Как размножается фаленопсис
6 способов размножения орхидеи Фаленопсис в домашних условиях
Орхидея фаленопсис — травянистое растение семейства орхидных. В дикой природе это растение обитает во влажных тёплых лесах. Фаленопсис представлен 3-6 широкими листами, расположенными поочерёдно, между которыми растёт цветонос, представленный гибкой длинной ветвью.
Уважаемые читатели! Для Вас мы создали сообщества в соц сетях, в которых несколько раз в день публикуются полезные статьи и интересные идеи! Подписывайтесь и получайте полезный контент в удобном формате!- ВКонтакте
- Одноклассники
- Яндекс.Дзен
Количество цветов зависит от ухода и разновидности растения, цветы могут иметь любой цвет, пятна и полосы.
Размножением фаленопсиса может заниматься даже неопытный цветовод.
Содержание
- Условия размножения
- Время
- Влажность
- Температура
- Общее состояние орхидеи
- Способы размножения орхидеи Фаленопсис
- Деление стебля (черенкование цветоноса)
- Получаем черенки со ствола
- Как вырастить в воде?
- Как размножить фаленопсис в воде?
- Важные условия ухода за срезанным цветоносом
- Как отсадить детки
- Как размножить с помощью цитокининовой пасты?
- Размножение семенами с фото в домашних условиях
- Как вырастить орхидею фаленопсис из семян, пошаговая инструкция?
- Как размножаются Фаленопсисы корнями?
- Возможные ошибки при размножении
- Уход за детками
- Полезное видео
- Вместо заключения
Условия размножения
Для получения положительных результатов в размножении орхидей необходимо соблюдать ряд правил. Выбрать правильно время посадки, соблюдать температурный режим, влажность и правильно выбрать растение от которого мы будем брать посадочный материал.
Выбрать правильно время посадки, соблюдать температурный режим, влажность и правильно выбрать растение от которого мы будем брать посадочный материал.
Время
Лучше всего заниматься размножением орхидеи фаленопсис, когда растение подходит к концу фазы цветения – тогда ресурсы цветка будут направлены на размножение.
Влажность
Идеальная влажность для орхидеи фаленопсис – 50-80%. Возможна влажность 25-85%, но для здорового размножения важна оптимальная влажность.
Температура
Для размножения фаленопсиса отлично подходит температура от 28 до 30 градусов, температура выше нормы допустима, но ниже – не рекомендуется.
Общее состояние орхидеи
Для размножения подходят только особи без заболеваний. Больное растение может иметь чёрные, в слизи или с желтизной, листья неестественного цвета, если вы видите хоть один из признаков, отложите размножение до времени выздоровления растения.
Способы размножения орхидеи Фаленопсис
Для того, чтобы размножить орхидею Фаленопсис есть несколько способов, ниже мы подробно рассмотрим каждый из них.
Деление стебля (черенкование цветоноса)
Одним из распространённых способов размножения орхидеи Фаленопсис является вегетативное размножение, или черенкование – деление стебля цветоноса на части. Оптимальный сезон для этого – конец весны — начало лета.
Получаем черенки со ствола
- Для начала, подготовьте растение к черенкованию: удалите нижние листья.
- Простерилизуйте срезы древесным или активированным углём.
- Обеспечьте растению максимально комфортные условия. Используйте максимум различных подкормок.
- Когда вырастут новые корни выше срезов, сделайте срез немного ниже появившихся новых корней.
- Простерилизуйте срезы.
- Высадите срезанный черенок в почву.
- Двое суток никак не поливайте и никак не увлажняйте почву, дайте молодым срезам высохнуть.
- Обеспечьте молодой орхидее оптимальные условия.

- Спустя несколько месяцев с пенька появятся новые растения.
Узнать больше о черенкование цветоноса орхидеи вы сможете из видео ниже:
Как вырастить в воде?
Размножение орхидеи фаленопсис можно произвести, срезав цветонос. Такой метод подходит, когда материнское растение сильно болеет и его нельзя спасти.
Как размножить фаленопсис в воде?
- Аккуратно срежьте цветонос растения.
- Поместите его в бутылку с отрезанным на 5 см горлышком, налейте в неё мягкую очищенную воду и добавьте одну таблетку активированного угля. Цветонос должен быть погружён под воду на 4-5 см нижней, срезанной частью.
- Пробудите спящую почку фаленопсиса, аккуратно срезав острой бритвой полукруглую чешуйку, закрывающую почку и смажьте её цитокининовой мазью, которую можно найти в любом цветочном магазине.

- Повторная обработка мазью потребуется каждую неделю на протяжении месяца.
- Меняйте жидкость в бутылке вместе с самой бутылкой с частотой 1 раз в неделю.
Важные условия ухода за срезанным цветоносом
- Температура должна не превышать 25 и не превышать 28 градусов, при иных условиях из почки вырастет не детка, а цветонос.
- В бутылку с чистой водой помимо активированного угля можно добавить минеральное удобрение в концентрации 1:4 от обычной.
- Отделите детку, когда у молодого растения появится 3-4 листа и корешки не менее 3-6 см. Просто срежьте её вместе с частью цветоноса, посадите в прозрачный горшок, наполненный корой и не допускайте прямого попадания лучей солнца.
Как отсадить детки
Важно, чтобы растение уже вышло из фазы цветения, было абсолютно здоровым и имело цветонос не старше 1.5-2 лет.
Сама детка выглядит как почка, расположенная на цветоносе.
Важные условия:
- Начинать стимуляцию роста почки желательно в феврале.
 Цветок нужно поставить с западной или восточной стороны, притенив листья и позволяя солнечным лучам попадать только на цветонос.
Цветок нужно поставить с западной или восточной стороны, притенив листья и позволяя солнечным лучам попадать только на цветонос. - Температура днём должна достигать 27 градусов, а ночью находиться в районе 16-17 градусов.
- Полив фаленопсиса желательно сократить до минимума.
- Подкормки вносить нельзя, пока не проснётся почка. Примерно через месяц такого ухода спящая почка просыпается.
После того как проснется почка вам нужно:
- Перенести растение в тёплое, но притенённое место. Подвергать детку воздействию прямых солнечных лучей нельзя.
- Нормализуйте режим полива вашего растения.
- Вносите внекорневые подкормки, то есть на листья. Когда растение достаточно разовьётся, можно начать вносить корневые.
Больше про размножение орхидеи Фаленопсис детками вы сможете узнать из видео ниже:
Как размножить с помощью цитокининовой пасты?
Способ размножения орхидеи фаленопсис цитокининовой пастой – один из самых простых и благодарных. Применять это способ лучше в конце зимы или весной, когда у растения больше всего жизненных сил и энергии.
Внимание! Цитокининовую пасту можно хранить только в холодильнике!
Итак, чтобы начать выращивание почки на стебле цветоноса, с помощью пасты нужно последовать инструкции ниже.
- Стерильным ножом или иглой царапните поверхность цветоноса.
- Нанесите примерно 1,5-2,3 миллиметра пасты на место царапины. Примерно через 10 дней почка начнёт зарождаться. Оптимальный вариант — наносить пасту при помощи зубочистки. Наносите её чуть больше, при недостаточном количестве цитокининовой пасты зародится новый цветонос, а не почка.
- Для пробуждения зародившейся почки срежьте защищающую её чешуйку и нанесите аналогичное количество пасты на почку.

- Через 10-20 дней почка пробудится, дайте ей отрастить два — три листа и корни 3-5 см и отсадите детку в горшок. Не подвергайте воздействию солнца.
Размножение семенами с фото в домашних условиях
Размножение семенами – один из самых сложных способов, ранее это считалось невозможным.
Основные причины, по которым этот способ используется не слишком часто и занимает так много времени и сил:
- Семена орхидеи очень маленькие и увидеть их невооружённым глазом практически невозможно.
- У них отсутствует эндосперм. Эндосперм – ткань, окружающая зародыш, питающая его и не дающая вредному влиянию окружающей среды повредить зародыш.
- Любое взаимодействие с окружающей средой, заболевания и отклонение от норм ухода приводит к гибели растения.
Как вырастить орхидею фаленопсис из семян, пошаговая инструкция?
Чтобы получить семена орхидеи самостоятельно нужно аккуратно опылить цветок с помощью зубочистки, как на фото в низу. Или можно купить готовые семена.
Или можно купить готовые семена.
После успешного опыления коробочки у орхидей начинают расти.
Через 6 месяцев коробочки с семенами орхидеи Фаленопсис созревают.
Далее выделяем семена из коробочки.
Чтобы сделать следующий шаг нужно приготовить питательную среду для растения. Есть несколько рецептов приготовления питательной смеси.
Рецепт 1
Вам потребуется 10-20 грамм порошка агар-агар, 10 грамм фруктозы, столько же глюкозы, немного ортофосфорной кислоты, карбоната кальция, а так же около 200 мл очищенной воды. позвольте набухнуть агар-агар в воде, перелейте полученное вами желе в кипяток и добавьте фруктозу с глюкозой, карбонат кальция и кислоту. Мешайте, пока не получите однородное вещество без кристалликов.
Рецепт 2
Еще один рецепт питательной среды. Нам нужно:
- 400 мл дистиллированной воды;
- 100 мл томатного сока;
- 20 гр сахара;
- 40 гр банана;
- 0,5 мл удобрения для орхидей;
- 2 таблетки активированного угля;
- 0,5 гр меда.

Выращивать орхидею нужно в стеклянных пробирках с герметичными пробками. Если у вас нет таких пробирок, возьмите маленькие банки с очень плотно закручивающимися крышками. Тщательно простерилизуйте банки, влейте туда по 30-50 мл питательной смеси.
Внимание! Очень важно сделать среду стерильной, иначе растения в смеси заведется плесень и растения не прорастут.
Повторно простерилизуйте банки, влив туда полученный раствор, на водяной бане и оставьте на 3-6 дней, чтобы убедиться, что дезинфекция прошла успешно. Если появится плесень – этот раствор нельзя использовать!
Покройте семена 1% раствором извести хлора и оставьте на 15-20 минут. 3-5 раз на протяжение этого времени активно трясите ёмкость.
Возьмите небольшую кастрюльку с кипятком, накройте её решёткой с ячейками, в которых вы сможете закрепить колбы или банки с питательной средой. Крышки должны так же лежать рядом для дезинфекции.
Аккуратно вытяните семена из раствора хлорной извести и поместите в питательную среду при помощи стерильного шприца. Тщательно закройте ёмкости и расположите их в теплице.
Тщательно закройте ёмкости и расположите их в теплице.
Через полгода аккуратно откройте ёмкости. В случае успешного прорастания семян вы увидите в банке ростки как на фото ниже.
Влейте 40-60 мл тёплой воды взбалтывайте до растворения. Вылейте полученное вещество в широкую миску и добавьте 2-5 капель 1% раствора Фурнадзола. Теперь оставьте ваши пророщенные семена на 15-20 минут.
Теперь, использую самую маленькую, тонкую и мягкую кисточку, высадите пророщенные семена по одному в горшки с питательной почвой из коры и мха. Добавьте к почве истолчённые корни папоротника и несколько истолчённых таблеток активированного угля.
Примерно через полгода можно будет пересадить проростки в почву, предназначенную для взрослых растений. К сожалению, цветения таким образом выращенных орхидей не стоит ждать ранее, чем через 4-7 лет.
Как размножаются Фаленопсисы корнями?
Размножение орхидеи корнями под силу даже новичку.
- Поднимите растение над горшком и аккуратно освободите от почвы.

- Разрежьте корневище стерильным ножом или секатором, оставляя по 2-3 псевдобульбы на росток.
- Присыпьте срезы порошком древесного угля.
- Каждую отделённую часть посадите в отдельный горшок со свежей почвой, опрыскивайте дважды в день, пока не появятся настоящие листочки и хорошие корни. Через некоторое время вы получите здоровое растение!
Возможные ошибки при размножении
Важными ошибками при размножении орхидеи фаленопсис является:
- Использование больного растения для размножения. Важно помнить, что растение с нездоровым цветом листьев, чёрными корнями, покрытыми слизью – важный знак, говорящий о том, что такое растение не стоит использовать для размножения.
- Единственный способ размножения, который можно применять с больным растением – размножение в воде.
- Важно помнить о стерилизации срезов, регулярном поливе.
- Не стоит подвергать растения воздействию прямых солнечных лучей, это вредно и опасно для растения, находящегося в процессе размножения.

- Необходимо давать растению оптимальные температуру, освещение и влажность, отклонение от нормы может закончиться неудачно.
Уход за детками
Для того, чтобы не только получить детку, но и вырастить её в здоровое и красивое растение, важно не забывать о правильном уходе.
- Маленькие растения нужно высаживать в такие горшки, в какие высаживают взрослые растения: прозрачные, с большим количеством отверстий. Так же можно добавлять к свежей почве взятую из горшка материнского растения в соотношении 1:1.
- Важно, чтобы молодые фаленопсисы получали оптимальные условия: температура и влажность нужны идеальные, и не позволяйте воздействовать на ростки прямым лучам солнца.
- Вносить подкормки следует в зависимости от способа размножения.
Полезное видео
Узнать больше о размножении Фаленопсис вы сможете узнать из видео ниже:
Вместо заключения
На самом деле, даже совершенно неопытному новичку под силу завести в своём доме ещё одну или две орхидеи, размножая в домашних условиях, главное – следовать инструкциям и не терять веру в себя!
Простой способ размножения орхидей – как можно спровоцировать появление деток?
Автор:
Валерий
https://floristics. info/ru/index.php?option=com_contact&view=contact&id=28
Категория: Комнатные растения Переиздано: Последние правки:
info/ru/index.php?option=com_contact&view=contact&id=28
Категория: Комнатные растения Переиздано: Последние правки:
Содержание
- Как увеличить количество отростков
- Видео о размножении орхидеи
- Литература
- В продолжение темы
- Комментарии
Здравствуйте, дорогие друзья! Сегодня я расскажу, как можно размножать фаленопсис с помощью деток.
У меня две орхидеи. Одной уже много лет, а вторую я приобрел недавно. Старую орхидею я регулярно размножаю с помощью деток. Те дочерние отростки, которые сейчас сформированы на цветоносе, отсаживать еще рано: у них только два листа, а нужно хотя бы 3-4.
Кроме того, у деток короткие корни, и нужно подождать, пока они удлинятся хотя бы до 5 см.
- Пафиопедилум: уход, размножение и виды
Как увеличить количество отростков
Появление деток нужно спровоцировать, но на одном растении их должно быть не более трех. Для того вам понадобится мох-сфагнум, цитокининовая паста и пластиковая бутылка емкостью 0,33 л. Разрежьте пластиковую бутылку поперек на 2 части, сделайте по центру дна отверстие диаметром с цветонос орхидеи и наденьте эту часть бутылки на отдыхающую после цветения цветочную стрелку дном вниз.
Для того вам понадобится мох-сфагнум, цитокининовая паста и пластиковая бутылка емкостью 0,33 л. Разрежьте пластиковую бутылку поперек на 2 части, сделайте по центру дна отверстие диаметром с цветонос орхидеи и наденьте эту часть бутылки на отдыхающую после цветения цветочную стрелку дном вниз.
Найдите на цветоносе спящую почку и осторожно снимите с нее иголкой кроющую чешую. Этой же иголкой слегка поцарапайте цветонос под почкой, а потом нанесите на почку и на поцарапанное место слой цитокининовой пасты.
Подведите под почку надетую на цветонос нижнюю часть бутылки, заполнив ее предварительно вымоченным в воде сфагнумом, а затем наденьте на цветонос верхнюю часть бутылки горлышком вверх и вставьте ее в нижнюю часть так, чтобы образовался баллон, со всех сторон окружающий почку. Почка должна быть полностью погружена в мох.
Теперь остается ждать, когда орхидея образует детку. Пластиковая бутылка будет предохранять сфагнум от высыхания. Время от времени можно снимать верхнюю часть бутылки для проветривания.
Если вы все сделаете правильно, то сможете в дальнейшем размножать свою орхидею бесконечное число раз.
Всего вам самого доброго.
- Цимбидиум: уход в домашних условиях, фото
Видео о размножении орхидеи
Литература
- Орхидные
- Размножение растений
В продолжение темы
- Как ухаживать за домашней орхидеей
- Каттлея: уход в домашних условиях, сорта
- Камбрия: выращивание в домашних условиях
- Уход за молодой орхидеей – как поливать и какое удобрение подойдет лучше всего?
- Как пересадить орхидею – шаг за шагом
Проверенный способ посева глоксинии на рассаду – как добиться 100% прорастания семян?
Псевдолитос: особенности ухода и виды
Разделы: Орхидеи
После этой статьи обычно читают
Добавить комментарийПрогресс и перспективы селекции орхидей: обзор
Априянти Д. Х., Аримурти А.М., Хандоко Л.Т. (2013) Идентификация видов орхидей с использованием поиска изображений цветов на основе содержимого. В: 2013 Международная конференция по компьютерам, управлению, информатике и их приложениям (IC3INA). IEEE, стр. 53–57
Х., Аримурти А.М., Хандоко Л.Т. (2013) Идентификация видов орхидей с использованием поиска изображений цветов на основе содержимого. В: 2013 Международная конференция по компьютерам, управлению, информатике и их приложениям (IC3INA). IEEE, стр. 53–57
CrossRef Google Scholar
Балилашаки К., Гантайт С., Надери Р., Вахеди М. (2015) Образование капсул и асимбиотическое прорастание семян у некоторых гибридов Phalaenopsis , зависит от сезона опыления и созревания коробочек. Physiol Mol Biol Plants 21(3):341–347
CrossRef пабмед ПабМед Центральный Google Scholar
Bezerra GA, Gabriel AVMD, Mariano ED, Cardoso JC (2020) Культивирование in vitro и акклиматизация в теплице Oncidium varicosum (Orchidaceae) с микроорганизмами, выделенными из его корней. Декоративный хортик 25: 407–416
Перекрёстная ссылка Google Scholar
Боланьос-Вильегас П.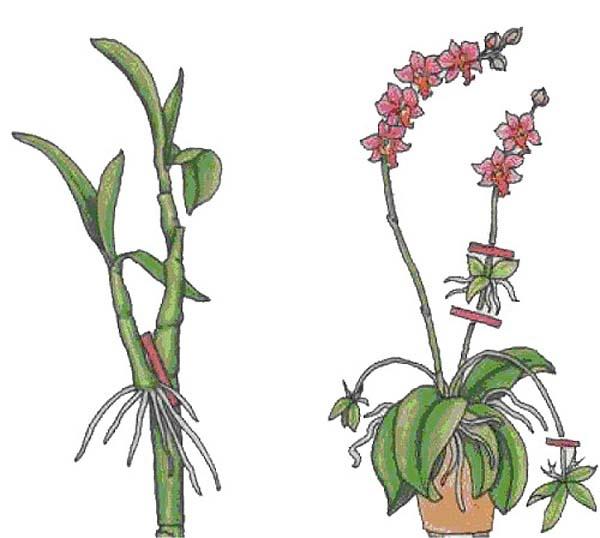 , Чанг С., Чен Ф.К. (2021 г.) Крошечный эпифит Erycina pusilla, модель для генома орхидей и селекционных исследований. В: Геном орхидеи. Springer, стр. 41–47
, Чанг С., Чен Ф.К. (2021 г.) Крошечный эпифит Erycina pusilla, модель для генома орхидей и селекционных исследований. В: Геном орхидеи. Springer, стр. 41–47
CrossRef Google Scholar
Bulpitt C (2005) Использование и неправильное использование орхидей в медицине. QJM 98(9):625–631
Перекрёстная ссылка КАС пабмед Google Scholar
Chai D, Yu H (2007) Последние достижения в производстве трансгенных орхидей. Orchid Sci Biotechnol 1(2):34–39
Google Scholar
Chang L, Chang H-H, Chiu Y-S, Chang J-C, Hsu D-W, Tzean Y, Cheng AP, Lu HC, Yeh H-H (2019) Растительные белки A20/AN1 координируют различные иммунные реакции, включая путь РНКи для противовирусного иммунитета. биоRxiv:622696
Google Scholar
Chao YT, Chen WC, Chen CY, Ho HY, Yeh CH, Kuo YT, Su CL, Yen SH, Hsueh HY, Yeh JH (2018) Сборка на уровне хромосом, генетическое и физическое картирование Phalaenopsis aphrodite Геном дает новое представление об адаптации видов и ресурсах для разведения орхидей. Plant Biotechnol J 16(12):2027–2041
Plant Biotechnol J 16(12):2027–2041
CrossRef КАС пабмед ПабМед Центральный Google Scholar
Cheamuangphan A, Panmanee C, Tansuchat R (2013) Анализ цепочки создания стоимости для бизнеса по производству срезанных орхидей в Чиангмае. Информация об автобусе: 712–721
Google Scholar
Chen J, Wang L, Chen J, Huang J, Liu F, Guo R, Yang L, Grabon A, Zhao K, Kong F (2018) Agrobacterium tumefaciens — система трансформации важного лекарственного растения Dendrobium catenatum Линдл. In Vitro Cell Dev Biol Plant 54(3):228–239
CrossRef Google Scholar
Chen WH, Kao Y-L, Tang CY, Jean G-T (2011) Энпополиплоидия в Орхидеи Phalaenopsis и их применение в селекции полиплоидов. В: Биотехнология орхидей II. World Scientific, стр. 25–48
CrossRef Google Scholar
Чин Д. П., Мишиба К-И, Мии М. (2007) Agrobacterium -опосредованная трансформация протокормоподобных телец в Cymbidium . Plant Cell Rep 26(6):735–743
П., Мишиба К-И, Мии М. (2007) Agrobacterium -опосредованная трансформация протокормоподобных телец в Cymbidium . Plant Cell Rep 26(6):735–743
CrossRef КАС пабмед Google Scholar
Chung Y-L, Kuo Y-T, Wu W-L (2017) Разработка маркеров SSR у орхидей Phalaenopsis , их характеристика, перекрестная передача и применение для идентификации. В: Биотехнология орхидей III. World Scientific, стр. 91–107
CrossRef Google Scholar
Claessens J, Kleynen J (2016) Orchidées dEurope. Флер и опыление. Biotope éditions, Mèze France, стр. 448
Google Scholar
Cui-Cui Y, Zhang Y, Jing-Hua Z, Yao-Yao C, An-Dong W (2010) Индукция тетраплоидов колхицином и идентификация в межвидовых гибридах Cymbidium . J Nuclear Agric Sci 24(3):518
Google Scholar
da Silva JAT, Winarto B, Dobránszki J, Cardoso JC, Zeng S (2016) Дезинфекция тканей для подготовки культуры. Folia Hortic 28(1):57–75
Folia Hortic 28(1):57–75
CrossRef Google Scholar
Де Л., Рао А., Радживан П., Патхак П. (2014) Улучшение орхидей — обзор. J Orchid Soc Индия 28:35–45
Google Scholar
De LC, Bhattacharjee SK (2011) Селекция декоративных культур. Aavishkar Publishers & Distributors, Джайпур, Раджастхан, Индия
Google Scholar
Дэн К.К. (1990) Культура орхидей. Szechuan Scientific Technology Press, Чэнду, Китай (на китайском языке)
Google Scholar
Fei X, Qinhua L, Wanping F, Yajun Y, Xinchao W, Xujun Z, Yuchun W (2020) Полногеномная идентификация и анализ экспрессии генов PAL в условиях биотического и абиотического стресса у Camellia sinensis . Acta Hortic Sinica 47(3):517
Google Scholar
Gao Y, Zhao Z, Li J, Liu N, Jacquemyn H, Guo S, Xing X (2020) Способствуют ли грибковые ассоциаты совместно встречающихся орхидей прорастанию семян широко распространенных видов орхидей Gymnadenia conopsea ? Микориза 30(2):221–228
CrossRef КАС пабмед Google Scholar
Холл А. Дж., Ричардс Р.А. (2013) Прогноз генетического улучшения потенциальной урожайности и урожайности основных зерновых культур при ограниченной воде. Field Crop Res 143:18–33
Дж., Ричардс Р.А. (2013) Прогноз генетического улучшения потенциальной урожайности и урожайности основных зерновых культур при ограниченной воде. Field Crop Res 143:18–33
CrossRef Google Scholar
Хартати С., Нандария Ю.А., Джоар Д.В. (2019) Метод гибридизации черной орхидеи ( Coelogyne pandurata Lindley), чтобы обогатить генетическое разнообразие и спасти генетическое вымирание. Болгарский J Agric Sci 25(4):751–755
Google Scholar
Хоссейн М.М., Кант Р., Ван П.Т., Винарто Б., Зенг С., Тейшейра да Силва Дж.А. (2013) Применение биотехнологии к орхидеям. Crit Rev Plant Sci 32(2):69–139
CrossRef КАС Google Scholar
Hsing HX, Lin YJ, Tong CG, Li MJ, Chen YJ, Ko SS (2016) Эффективная и наследуемая трансформация орхидей Phalaenopsis . Bot Stud 57(1):1–12
CrossRef КАС Google Scholar
Индан Х. , Дэвид Д., Джаван Р., Марбави Х., Гансау Дж.А. (2021) Развитие и характеристика цветка и капсулы драгоценной орхидеи Борнео Macodes limii JJ дерево и ягненок AL (Orchidaceae: Asparagales). J Asia-Pac Biodivers 14(2):236–241
, Дэвид Д., Джаван Р., Марбави Х., Гансау Дж.А. (2021) Развитие и характеристика цветка и капсулы драгоценной орхидеи Борнео Macodes limii JJ дерево и ягненок AL (Orchidaceae: Asparagales). J Asia-Pac Biodivers 14(2):236–241
Перекрёстная ссылка Google Scholar
Jiang G-L (2015) Молекулярно-маркерная селекция: обзор селекционера. В: Достижения в стратегиях селекции растений: селекция, биотехнология и молекулярные инструменты. Springer, стр. 431–472
CrossRef Google Scholar
Джоффард Н., Массол Ф., Гренье М., Монжелард С., Шац Б. (2019) Влияние стратегии опыления, филогении и распределения на ниши опыления евро-средиземноморских орхидей. Дж. Экол. 107 (1): 478–49.0
Перекрестная ссылка Google Scholar
Джонсон С.Д., Эдвардс Т. (2000) Структура и функция поллинарии орхидеи. Plant Syst Evol 222(1):243–269
CrossRef Google Scholar
Khumkarjorn N, Thanonkeo S, Yamada M, Klanrit P, Thanonkeo P (2017) Agrobacterium -опосредованная трансформация орхидеи Dendrobium с геном флаванон-3-гидроксилазы. Терк Дж. Бот 41 (5): 442–454
Терк Дж. Бот 41 (5): 442–454
Перекрёстная ссылка КАС Google Scholar
Кнудсон Л. (1922) Несимбиотическое прорастание семян орхидей. Бот Газ 73(1):1–25
CrossRef Google Scholar
Kuehnle AR, Sugii N (1992) Трансформация орхидеи dendrobium с помощью бомбардировки протокорм частицами. Plant Cell Rep 11(9):484–488
CrossRef КАС пабмед Google Scholar
Лэнгридж П., Флери Д. (2011) Максимальное использование «омики» для селекции сельскохозяйственных культур. Trends Biotechnol 29(1):33–40
CrossRef КАС пабмед Google Scholar
Lapjit C, Tseng M-J (2015) Влияние светодиодов (светоизлучающих диодов) на рост in vitro Erycina pusilla . Хортик НЧУ 40(2):23–38
Google Scholar
Lee S-H, Li C-W, Liau C-H, Chang P-Y, Liao L-J, Lin CS, Chan MT (2015) Создание процедуры генетической трансформации, опосредованной Agrobacterium , для экспериментальной модели орхидеи Erycina pusilla . Культ органов растительных клеток и тканей 120(1):211–220
Культ органов растительных клеток и тканей 120(1):211–220
CrossRef КАС Google Scholar
Li C-W, Chan MT (2018) Последние протоколы генетической трансформации видов орхидей. В: Размножение орхидей: от лабораторий до теплиц — методы и протоколы. Спрингер, стр. 367–383
Google Scholar
Li D, Zhao C, Liu X, Liu X, Lin Y, Liu J, Chen H, Lǚ F (2015) Сборка de novo и характеристика корневого транскриптома и развитие маркеров повторения простой последовательности у Paphiopedilum concolor . Genet Mol Res 14(2):6189–6201
CrossRef КАС пабмед Google Scholar
Li Q, Su X, Ma H, Du K, Yang M, Chen B, Fu S, Fu T, Xiang C, Zhao Q (2021) Разработка ресурсов генных маркеров SSR на основе данных РНК-секвенирования в Camellia japonica и их применение в роде Camellia . Научный представитель 11(1):1–11
Google Scholar
Lin CS, Hsu CT, Liao DC, Chang WJ, Chou ML, Huang YT, Chen JJ, Ko SS, Chan MT, Shih MC (2016) Транскриптомный анализ семейства генов MADS-box в орхидее Эрицина пустилла . Plant Biotechnol J 14(1):284–298
Plant Biotechnol J 14(1):284–298
CrossRef КАС пабмед Google Scholar
Lu J, Liu Y, Xu J, Mei Z, Shi Y, Liu P, He J, Wang X, Meng Y, Feng S (2018) Создание генетической карты высокой плотности и общий QTL, связанный с содержанием полисахаридов в стебле разведка китайского эндемика Dendrobium (Orchidaceae). Front Plant Sci 9:398
CrossRef пабмед ПабМед Центральный Google Scholar
Luo Y, Huang M, Wu J (2012) Прогресс в исследовании разведения Oncidium . Acta Agric Цзянси 24 (10): 15–20
КАС Google Scholar
Murthy HN, Paek KY, Park SY (2018) Микроразмножение орхидей с использованием биореакторной технологии. В: Размножение орхидей: от лабораторий до теплиц — методы и протоколы. Спрингер, стр. 195–208
Google Scholar
Нирмала С. , Нонгдам П., Тевари Р. (2006) Биотехнологические и молекулярные подходы к улучшению орхидей. Биотехнология растительных клеток Мол Биол 7:1–10
, Нонгдам П., Тевари Р. (2006) Биотехнологические и молекулярные подходы к улучшению орхидей. Биотехнология растительных клеток Мол Биол 7:1–10
КАС Google Scholar
Raffeiner B, Serek M, Winkelmann T (2009) Agrobacterium tumefaciens -опосредованная трансформация видов орхидей Oncidium и Odontoglossum с мутантным геном рецептора этилена et р1-1. Культ органов растительных клеток и тканей 98(2):125–134
CrossRef КАС Google Scholar
Рейникка М.А. (1972) История орхидеи: Мерле А. Университет Майами Пресс, Рейникка. Флорида
Google Scholar
Reyes HC, Draper D, Marques I (2021) Опыление в тропических лесах: мало посетителей и малоэффективные опылители ограничивают успех плодоношения тропических орхидей. Насекомые 12(10):856
CrossRef пабмед ПабМед Центральный Google Scholar
Sawettalake N, Bunnag S, Wang Y, Shen L, Yu H (2017) DOAP1 способствует цветению орхидей Дендробиум Улыбка Чао Прайя. Front Plant Sci 8:400
Front Plant Sci 8:400
CrossRef пабмед ПабМед Центральный Google Scholar
Schatz B, Sauvion N, Kjellberg F, Nel A (2017) Взаимодействие растений и насекомых: палеонтологическая и эволюционная перспективы. Adv Bot Res 81:1–24
CrossRef Google Scholar
Schiff JL (2018) Редкие и экзотические орхидеи: их природа и культурное значение. Спрингер
Перекрёстная ссылка Google Scholar
Семиарти Э., Нопитасари С., Сетиавати Й., Лори М.Д., Пурванторо А., Видада Дж., Йошиока Й., Мацумото С., Ниномия К., Асано Й. (2020) Применение системы редактирования генома CRISPR/Cas9 для молекулярной селекции орхидей. Indian J Biotechnol 25(1):61–68
CrossRef Google Scholar
Сетиавати Ю., Нопитасари С., Лори М.Д., Пурванторо А., Видада Дж. , Сасонко А.Б., Ниномия К., Асано Ю., Мацумото С., Йошиока Ю. (2020) Опосредованная Agrobacterium трансформация упрощает работу системы редактирования генома CRISPR/Cas9 у Dendrobium macrophyllum A. Богатая орхидея. В: Труды конференции AIP. ООО «АИП Паблишинг», т. 060016
, Сасонко А.Б., Ниномия К., Асано Ю., Мацумото С., Йошиока Ю. (2020) Опосредованная Agrobacterium трансформация упрощает работу системы редактирования генома CRISPR/Cas9 у Dendrobium macrophyllum A. Богатая орхидея. В: Труды конференции AIP. ООО «АИП Паблишинг», т. 060016
Google Scholar
Шекарриз П., Кафи М., Дейлами С.Д., Мирмасуми М. (2014) Кокосовая вода и пептон улучшают прорастание семян и образование протокормообразного тела гибрида Phalaenopsis . Сельскохозяйственные науки Dev 3 (10): 317–322
Google Scholar
Shrestha BR, Chin DP, Tokuhara K, Mii M (2007)Эффективное производство трансгенных растений Ванды с помощью обработки ультразвуком Agrobacterium -опосредованная трансформация протокормоподобных тел. Биотехнология растений 24(4):429–434
CrossRef КАС Google Scholar
Шрирам V, Кумар V (2022) Eulophia spp. : Поколение In Vitro , химические составляющие и фармакологическая активность. В кн.: Фитохимия, биология и садоводство орхидей. Springer, стр. 495–516
: Поколение In Vitro , химические составляющие и фармакологическая активность. В кн.: Фитохимия, биология и садоводство орхидей. Springer, стр. 495–516
CrossRef Google Scholar
Tang C-Y, Chen W-H (2007) Выведение и разработка новых сортов Phalaenopsis . В: Биотехнология орхидей. World Scientific, стр. 1–22
Google Scholar
Тивари П., Шарма А., Бозе С.К., Гаутам А. (2022) Биотехнологические вмешательства в орхидеи: последние обновления, успех перевода и коммерческие результаты
Google Scholar
Tong CG, Wu FH, Yuan YH, Chen YR, Lin CS (2020) Высокоэффективное редактирование на основе CRISPR/Cas генов MADS орхидеи Phalaenopsis . Завод биотехнологии J 18(4):889
CrossRef пабмед Google Scholar
Utami ESW, Hariyanto S (2019) Прорастание семян in vitro и развитие рассады редкой местной индонезийской орхидеи Phalaenopsis amboinensis JJ Sm. Scientifica 2019:1
Scientifica 2019:1
CrossRef Google Scholar
Wang J, Liu Z, Zhang G, Niu S, Zhang Y, Peng C (2020) Эволюция двух убиквитин-подобных систем аутофагии у орхидей. Завод Hortic J 6(5):321–334
CrossRef Google Scholar
Wang P, Zheng Y, Lin Y, Zhou Z, Yang J, Ye N (2019) Полногеномная идентификация и анализ экспрессии семейства генов GRF в Camellia sinensis . Acta Botan Boreali-Occiden Sin 39(3):413–421
Google Scholar
Wang S-Y, Lee P-F, Lee Y-I, Hsiao Y-Y, Chen Y-Y, Pan Z-J, Liu Z-J, Tsai WC (2011) Дублированные гены MADS-box C-класса обнаруживают различные роли в развитии гиностемия у Cymbidium ensifolium (Орхидные). Физиол клеток растений 52(3):563–577
CrossRef КАС пабмед Google Scholar
Xing M, Liu X, Kong C, Yang L, Zhuang M, Zhang Y, Wang Y, Fang Z, Lü H (2019) Полногеномная идентификация и эволюционный анализ генов семейства NLR капусты и профилей их экспрессии в реакция на различные патологические стрессы. Acta Hortic Sinica 46(4):723–737
Acta Hortic Sinica 46(4):723–737
Google Scholar
Xu Q, Wang S, Hong H, Zhou Y (2019) Транскриптомное профилирование пути биосинтеза аромата цветка Cymbidium faberi Rolfe и функциональная характеристика его гена карбоксиметилтрансферазы жасмоновой кислоты. BMC Genomics 20(1):1–14
CrossRef Google Scholar
Ям Т.В., Ардитти Дж. (2009) История размножения орхидей: зеркало истории биотехнологии. Завод Биотехнолог Реп. 3(1):1–56
Перекрёстная ссылка Google Scholar
Yamaguchi H (2018) Мутационная селекция декоративных растений с использованием ионных пучков. Breed Sci 68(1):17086
CrossRef Google Scholar
Yang J, Lee HJ, Shin D, Oh S, Seon J, Paek K, Han KH (1999) Генетическая трансформация орхидеи cymbidium путем бомбардировки частицами. Plant Cell Rep 18(12):978–984
Plant Cell Rep 18(12):978–984
CrossRef КАС Google Scholar
Yee NC, Abdullah JO, Mahmood M, Basiron N (2008) Совместный перенос генов gfp, CHS и hptII в Oncidium Sharry baby PLB с использованием биолистического пистолета. Afr J Biotechnol 7(15)
Google Scholar
You S-J, Liau C-H, Huang HE, Feng TY, Prasad V, Hsiao H-H, Lu J-C, Chan MT (2003) Ген ферредоксиноподобного белка сладкого перца (pflp) как новый маркер селекции для трансформации орхидей. Планта 217(1):60–65
Перекрёстная ссылка КАС пабмед Google Scholar
Zhang L, Chin DP, Mii M (2010) Agrobacterium -опосредованная трансформация протокормоподобных телец у Cattleya . Plant Cell Tissue Organ Cult 103(1):41–47
CrossRef Google Scholar
Zhang Q, Li Z, Tang M, Xu C, Xi H (2011) Исследование использования колхицина для индукции полиплоидии Dendrobium candidum стенка. бывший Линдл. Юньнаньский сельскохозяйственный университет 26 (5): 678–682
бывший Линдл. Юньнаньский сельскохозяйственный университет 26 (5): 678–682
Google Scholar
ENh2260/EP521: Биология опыления орхидей
Хейли Рэй и Вагнер Вендраме
Введение
Orchidaceae — одно из крупнейших семейств цветковых растений в мире, насчитывающее почти 30 000 видов (Brown 2005). Давление отбора на некоторые таксоны орхидей (группы родственных орхидей) привело к возникновению резких морфологических (физических и структурных) различий между линиями орхидей (Kew Royal Botanic Gardens 2013). Одной из уникальных черт, развившихся у орхидей, является слияние тычинок (все мужские репродуктивные части — пыльники и нити) с пестиком (все женские репродуктивные части — рыльце, столбик и завязь) в цветке. Это сокращение количества тычинок привело к тому, что группы орхидей состояли только из трех, двух или одной тычинки. Более 99% всех описанных видов орхидей имеют в цветке только одну тычинку, что является характерным признаком Orchidaceae (Kew Royal Botanic Gardens 2013).
Большинство цветков орхидей имеют одинаковые основные репродуктивные структуры (рис. 1). Центральная структура, известная как столбик, представляет собой уникальную адаптацию орхидей, в которой находятся как мужская (пыльник), так и женская (стигма) части цветка (Робертс и Диксон, 2008). Колонка — по крайней мере, ее дистальная (вдали от центра) часть — ориентирована горизонтально. Пыльник расположен на дистальном конце столбика. Рыльце расположено у дистального конца и сразу на нижней стороне колонки. Непосредственно под колонкой находится губа, или губа, видоизмененный лепесток, который действует как посадочная площадка для опылителей (Brown 2005).
Рисунок 1. Строение цветка орхидеи Ванда, включая лепестки, чашелистики и столбик.Авторы и права: Хейли Рэй, UF/IFAS
Цветочные нектарники (ткань на растении, вырабатывающая нектар) обычно располагаются у основания губной губы или в виде нектарного шпорца позади цветка. Когда опылитель движется по лабеллуму, он вступает в контакт с пыльцой. В отличие от рыхлых — и часто разносимых ветром — пыльцевых зерен большинства семейств цветковых растений, пыльцевые зерна орхидей сливаются вместе в компактные структуры, называемые поллиниями. Поллинии (от двух до восьми шишевидных пакетиков пыльцы) расположены под колпачком мужского пыльника и содержат липкую структуру, называемую висцидием (рис. 2), которая помогает поллиниям прикрепляться к опылителю, когда тот питается или пытается спариваться с опылителем. колонка (Робертс и Диксон, 2008). Когда опылитель посещает другой цветок, поллинии, вероятно, переносятся на рыльце пестика.
В отличие от рыхлых — и часто разносимых ветром — пыльцевых зерен большинства семейств цветковых растений, пыльцевые зерна орхидей сливаются вместе в компактные структуры, называемые поллиниями. Поллинии (от двух до восьми шишевидных пакетиков пыльцы) расположены под колпачком мужского пыльника и содержат липкую структуру, называемую висцидием (рис. 2), которая помогает поллиниям прикрепляться к опылителю, когда тот питается или пытается спариваться с опылителем. колонка (Робертс и Диксон, 2008). Когда опылитель посещает другой цветок, поллинии, вероятно, переносятся на рыльце пестика.
Авторы и права: Хейли Рэй, UF/IFAS
Если опыление прошло успешно, пыльцевая трубка разовьется и вырастет, а завязь цветка начнет набухать и в конечном итоге сформирует семенную коробочку, заполненную сотнями тысяч или миллионами семян (Робертс и Диксон, 2008). После созревания семенной коробочки семена высвобождаются и разносятся ветром до тех пор, пока они не соприкоснутся с субстратом (поверхностью, на которой живет растение) для прорастания. Однако семенам орхидей не хватает эндосперма, который является питательной тканью, поддерживающей развитие зародыша и прорастание семян. Следовательно, семена орхидеи должны ассоциироваться с микоризальными грибами, которые помогают семенам поглощать воду и питательные вещества и превращать целлюлозу и другие сложные молекулы в субстрате в простые сахара, необходимые орхидее. Следовательно, все представители Orchidaceae производят семена, которые полагаются на субстрат с микоризными грибами, чтобы завершить свой жизненный цикл in situ (Rasmussen 19).95).
Однако семенам орхидей не хватает эндосперма, который является питательной тканью, поддерживающей развитие зародыша и прорастание семян. Следовательно, семена орхидеи должны ассоциироваться с микоризальными грибами, которые помогают семенам поглощать воду и питательные вещества и превращать целлюлозу и другие сложные молекулы в субстрате в простые сахара, необходимые орхидее. Следовательно, все представители Orchidaceae производят семена, которые полагаются на субстрат с микоризными грибами, чтобы завершить свой жизненный цикл in situ (Rasmussen 19).95).
Микоризные ассоциации различаются среди орхидей. Эпифиты (растение, безвредно прикрепленное к другому растению) могут использовать гриб только на этапе прорастания семян, при этом взрослые особи полагаются на поглощение питательных веществ дождевыми и стоковыми водами, в то время как наземные растения (живущие в земле) могут иметь высокий уровень постоянной зависимости от микоризы ( Робертс и Диксон, 2008 г.). Для того чтобы эпифитная орхидея проросла, микоризный гриб должен присутствовать в том месте, куда попадает рассеянное ветром семя.
Как опыляются орхидеи
Цветки Orchidaceae опыляются различными таксонами позвоночных и беспозвоночных. Пчелы и осы (отряд Hymenoptera) являются обычными опылителями орхидей, хотя организмы отрядов Lepidoptera, Diptera, Coleoptera и других также опыляют орхидеи, как и некоторые мелкие птицы (Statman-Weil 2001, Hawkeswood and Turner 2004, Lehnebach and Robertson 2004, Micheneau и др., 2010 г., Newman и др., 2011 г., Stökl и др., 2011 г.).
Существует множество различных взаимоотношений орхидей и опылителей. Некоторые виды орхидей опыляются многочисленными таксонами, в то время как другие являются специализированными и опыляются только одним видом опылителей. Орхидеи, которые имеют специализированные отношения только с одним видом опылителей, часто имеют более эффективный перенос пыльцы, чем орхидеи, которые полагаются на несколько общих опылителей. Специализация позволяет напрямую передавать пыльцу одному и тому же виду орхидей и снижает вероятность того, что пыльца будет сброшена или передана не тому виду орхидей (Scopece et al. 2010). Кроме того, специализация может включать прикрепление пыльцы к одному конкретному месту на опылителе, гарантируя, что даже если опылитель посетит другой вид, пыльца, вероятно, не будет передана до тех пор, пока опылитель повторно не посетит орхидею того же вида, который пожертвовал пыльцу (Scopece и др., 2010).
2010). Кроме того, специализация может включать прикрепление пыльцы к одному конкретному месту на опылителе, гарантируя, что даже если опылитель посетит другой вид, пыльца, вероятно, не будет передана до тех пор, пока опылитель повторно не посетит орхидею того же вида, который пожертвовал пыльцу (Scopece и др., 2010).
Методы привлечения
Поскольку орхидеи очень разнообразны, системы опыления очень разнообразны и могут быть чрезвычайно специализированными или сложными. Многие орхидеи не полагаются на поиск нектара опылителем, а используют некоторую форму обмана, чтобы привлечь опылителей, часто с помощью внешнего вида, химических сигналов или комбинации того и другого (Wong and Schiestl 2002).
Ophrys apifera , или пчелиная орхидея (рис. 3), является наиболее известным примером орхидеи, которая использует внешний вид своих цветков, чтобы обмануть опылителей. Губа цветка этого вида напоминает самку вида одиночной пчелы ( Eucera spp.; перепончатокрылые; Anthophoridae), сидящие на цветке. Одиночные виды пчел-самцов пытаются совокупиться с цветком и в конечном итоге уходят в поисках других самок. Во время этих попыток спаривания поллиниум прикрепляется к самцу пчелы. Когда пчела обманывается другим цветком и пытается спариться с ним, поллиний переносится на рецептор пыльцы другого цветка (рыльце), что приводит к опылению (Devey 2008). Это также называется псевдокопуляцией.
Одиночные виды пчел-самцов пытаются совокупиться с цветком и в конечном итоге уходят в поисках других самок. Во время этих попыток спаривания поллиниум прикрепляется к самцу пчелы. Когда пчела обманывается другим цветком и пытается спариться с ним, поллиний переносится на рецептор пыльцы другого цветка (рыльце), что приводит к опылению (Devey 2008). Это также называется псевдокопуляцией.
Авторы и права: BerndH (http://creativecommons.org/licenses/by-sa/3.0/)
Орхидея Drakaea (рис. 4) является примером орхидеи, которая использует комбинацию физических и химических сигналов. Цветки этой орхидеи напоминают самок ос из рода Zaspilothynnus (Tiphiidae) и выделяют химическое вещество, имитирующее брачный феромон этой самки осы. Когда самцы пытаются спариться с цветами, они контактируют с поллиниями. Когда они начинают этот процесс со следующего цветка, пыльца переносится.
Рисунок 4. Цветок Drakaea livida , орхидеи, визуально напоминающей осу в полете.
Авторы и права: Майлз Х. М. Менц, Райан Д. Филлипс, Кингсли В. Диксон, Род Пиколл и Рафаэль К. Дидхэм (http://creativecommons.org/licenses/by/2.5/)
Некоторые орхидеи привлекают насекомых-опылителей, выделяя соединения, напоминающие феромоны партнера, или выделяя химическое вещество, которое может быть собрано опылителем и использовано для защиты или привлечения партнера (Wong and Schiestl 2002). Одним из примеров этого вида орхидей является Эпидендрум метельчатый . Он выделяет пирролизидиновые алкалоиды (ПА), которые самцы чешуекрылых подсемейства мотыльков Arctiinae и нимфалидных бабочек подсемейств Ithomiinae и Danainae используют как для поиска партнеров, так и для защиты (DeVries and Stiles 1990). ДеВрис и Стайлз (1990) исследовали E . paniculatum в Коста-Рике вместе с приманками PA и обнаружили, что 98% насекомых, привлеченных цветами и приманками, были самцами чешуекрылых, которые используют PA для привлечения партнеров и защиты от хищников.
Помимо обмана, орхидеи могут использовать ловушки, триггеры или ложные вознаграждения нектаром для привлечения опылителей. Орхидеи рода Coryanthes , или орхидеи ведра, используют метод ловушки для опыления. У этих орхидей видоизмененная губа, образующая ведро (рис. 5). Цветок выделяет в эти ведра жидкость, которая привлекает самцов пчел-эуглоссинов. У пчел на задних лапах есть мешкообразная структура, в которой они хранят масло, выделяемое этими орхидеями. Позже это масло используется в ухаживаниях для привлечения самок. Когда пчелы летят собирать масло, они застревают в ведре. Есть только одна часть цветка, которая позволяет пчелам убежать, и когда пчелы выбираются из ловушки, они вынуждены вступать в контакт с поллиниями. Они временно оказываются в ловушке, пока поллинии прикреплены к грудной клетке пчел; затем, когда пчела собирает масло с еще одного цветка, поллинии переносятся на него. В результате этот механизм обеспечивает перекрестное опыление.
Рисунок 5. Coryanthes ведерко орхидеи, которая выделяет масло, привлекающее самца эуглосиновой пчелы, после чего самец захлопывается, чтобы поймать самца, который, высвобождаясь, вступает в контакт с поллиниями.
Coryanthes ведерко орхидеи, которая выделяет масло, привлекающее самца эуглосиновой пчелы, после чего самец захлопывается, чтобы поймать самца, который, высвобождаясь, вступает в контакт с поллиниями. Авторы и права: Orchi, (http://creativecommons.org/licenses/by-sa/3.0/)
В то время как некоторые орхидеи используют обман, чтобы инициировать опыление, другие развили другие очень специализированные отношения со своими насекомыми-опылителями. Орхидея Angraecum sesquipedale , или орхидея Дарвина, и Dendrophylax lindenii , или орхидея-призрак (рис. 6), которая произрастает в южной Флориде, оба нуждаются в определенном чешуекрылом опылителе. У этих орхидей есть длинная нектарная шпора, до которой может дотянуться только бражник своим длинным хоботком (удлиненной сосущей ротовой частью) (Крицкий, 1991).
Рисунок 6. Орхидея-призрак, Dendrophylax lindenii , с нектарной шпорой позади цветка.Авторы и права: Хейли Рэй, UF/IFAS
Таксоны опылителей орхидей
Хотя до сих пор в примерах подробно описаны перепончатокрылые и чешуекрылые опылители, другие отряды насекомых также были задокументированы как опылители орхидей.
В качестве опылителей орхидей двукрылые менее важны, чем обсуждавшиеся ранее отряды насекомых, хотя существует несколько видов орхидей, опыляемых двукрылыми. Одним из примеров является орхидея Epipactis veratrifolia , которая опыляется журчалками (также известными как цветочные мухи; Syrphidae), личинки которых питаются тлями. Этот цветок выделяет химическое соединение, которое имитирует феромон тревоги тли, сигнализируя взрослой самке журчалки, что для ее потомства будет запас пищи (Stökl et al. 2011). Когда самка журчалки прилетает к цветку в поисках тли и места для откладывания яиц (откладывания яиц), она вступает в контакт с поллиниями. Это часто приводит к тому, что самки откладывают яйца в цветок орхидеи (Stökl et al. 2011).
Существует также несколько семейств жесткокрылых (Hawkeswood and Turner 2004) и одно прямокрылое, неописанный вид скрипучего сверчка из семейства Gryllacrididae, которые, как было установлено, опыляют орхидеи. Исследователи из Королевского ботанического сада Кью обнаружили крикетного сверчка, опыляющего орхидею Angraecum на острове Реюньон у побережья Мадагаскара (Micheneau et al. 2010).
2010).
Хотя они являются наиболее частыми опылителями орхидей, насекомые — не единственный таксон, оказывающий эту услугу. Колибри и улитки также могут влиять на опыление. Хотя только около 3% орхидей опыляются колибри, общее количество видов орхидей, опыляемых колибри, по-прежнему составляет около 1000 видов (Siegel 2011). Орхидеи, опыление которых зависит от колибри, ярко окрашены и часто не имеют запаха. Многие из орхидей, опыляемых колибри, дают темные поллинии с оттенками серого, синего или коричневого. Эти цвета похожи на цвета клювов колибри, что снижает вероятность того, что птица заметит поллинии и очистит их от клюва при уходе за собой (Siegel 2011).
Автогамия
Орхидеи также могут размножаться без использования опылителей. В спонтанных автогамных системах (автоопыление) поллинии располагаются на рыльце пестика, и опыление происходит в отсутствие опылителя. Этот процесс происходит с помощью нескольких механизмов, включая порошкообразные поллинии, расширение поллиниев или деформацию части колонны (Catling 1990, Gale 2007). Благодаря автогамии виды орхидей, проявляющие эту черту, не нуждаются в подходящем опылителе. Считается, что автогамия способствует расширению ареала растения в районы, где опылители редки или отсутствуют, а автогамия может быть следствием расширения ареала (Catling 19).90). Фенстер и Мартен-Родригес (2007) предполагают, что автогамия может быть более широко распространена, чем считалось ранее, и что автоопыление могло развиваться вместе с самоопылением, чтобы адаптироваться к давлению отбора. Эти нагрузки включают ограничение количества опылителей, поскольку самоопыление может обеспечить репродуктивную страховку от отсутствия специализированных опылителей орхидей (Fenster and Martén-Rodriguez 2007).
Благодаря автогамии виды орхидей, проявляющие эту черту, не нуждаются в подходящем опылителе. Считается, что автогамия способствует расширению ареала растения в районы, где опылители редки или отсутствуют, а автогамия может быть следствием расширения ареала (Catling 19).90). Фенстер и Мартен-Родригес (2007) предполагают, что автогамия может быть более широко распространена, чем считалось ранее, и что автоопыление могло развиваться вместе с самоопылением, чтобы адаптироваться к давлению отбора. Эти нагрузки включают ограничение количества опылителей, поскольку самоопыление может обеспечить репродуктивную страховку от отсутствия специализированных опылителей орхидей (Fenster and Martén-Rodriguez 2007).
Автогамия не редкость среди Orchidaceae (Johnson et al. 2009). Сообщается, что более 350 видов орхидей проявляют автогамию, и, по оценкам, по крайней мере 20% видов, встречающихся в Эквадоре и Пуэрто-Рико, являются автогамными (Ackerman 19).83, Кэтлинг, 1990). Было замечено, что несколько видов орхидей, найденных в южной Флориде, проявляют автогамию. В этих отчетах образование семенных коробочек не исследовалось, что затрудняет определение того, является ли автогамия предпочтительным методом производства семенных коробочек с точки зрения качества и количества производимых семян (Goss 1973, Johnson et al. 2009). Исследование Джонсона и соавт. (2009) исследовали систему размножения флоридской наземной орхидеи Eulophia alta (рис. 7), которая, как сообщается, является автогамной. В тех случаях автоопыления они обнаружили, что только 7,1% цветков образуют семенные коробочки, и эти данные указывают на то, что автогамия редко встречается в 9 странах.0551 E. alta (Джонсон и др., 2009). Это исследование предполагает, что капсулы, образующиеся естественным образом в поле, могут быть результатом событий опыления, которые не наблюдались.
В этих отчетах образование семенных коробочек не исследовалось, что затрудняет определение того, является ли автогамия предпочтительным методом производства семенных коробочек с точки зрения качества и количества производимых семян (Goss 1973, Johnson et al. 2009). Исследование Джонсона и соавт. (2009) исследовали систему размножения флоридской наземной орхидеи Eulophia alta (рис. 7), которая, как сообщается, является автогамной. В тех случаях автоопыления они обнаружили, что только 7,1% цветков образуют семенные коробочки, и эти данные указывают на то, что автогамия редко встречается в 9 странах.0551 E. alta (Джонсон и др., 2009). Это исследование предполагает, что капсулы, образующиеся естественным образом в поле, могут быть результатом событий опыления, которые не наблюдались.
Авторы и права: Жоао Медейрос (http://creativecommons.org/licenses/by/2.0/)
Исследования будущего
Взаимодействия между орхидеями и их опылителями разнообразны и часто сложны. Чтобы полностью понять эти взаимодействия, требуется много исследований, а опылители многих видов орхидей до сих пор неизвестны. Имея около 30 000 видов орхидей, вероятно, существует множество других таксонов как насекомых, так и ненасекомых опылителей. Орхидеи используют чрезвычайно широкий спектр известных методов для опыления, обычно с использованием химических или визуальных сигналов, включая мимикрию. Эти характеристики помогают продемонстрировать, как орхидеи стали такими разнообразными, и делают орхидеи модельной системой для изучения цветочной адаптации и разнообразия.
Чтобы полностью понять эти взаимодействия, требуется много исследований, а опылители многих видов орхидей до сих пор неизвестны. Имея около 30 000 видов орхидей, вероятно, существует множество других таксонов как насекомых, так и ненасекомых опылителей. Орхидеи используют чрезвычайно широкий спектр известных методов для опыления, обычно с использованием химических или визуальных сигналов, включая мимикрию. Эти характеристики помогают продемонстрировать, как орхидеи стали такими разнообразными, и делают орхидеи модельной системой для изучения цветочной адаптации и разнообразия.
Каталожные номера
Акерман, Дж. Д. 1983. «Разнообразие и сезонность самцов пчел Euglossine (Hymenoptera: Apidae) в центральной Панаме». Экология 64: 274–283.
Brown, PM 2005. Дикие орхидеи Флориды: со ссылками на прибрежные равнины Атлантики и Мексиканского залива . Гейнсвилл, Флорида: Университетское издательство Флориды, Гейнсвилл, 432.
. Catling, PM 1990. «Автоопыление Orchidaceae». В Биология орхидей: обзоры и перспективы , под редакцией Дж. Ардитти, 121–158. Портленд, Орегон: Timber Press.
«Автоопыление Orchidaceae». В Биология орхидей: обзоры и перспективы , под редакцией Дж. Ардитти, 121–158. Портленд, Орегон: Timber Press.
Деви, Д. 2008. «Офрис: случай ложного происхождения видов». Кью Ученый 33: 1.
ДеВриз, П.Дж. и Ф.Г. Стайлз. 1990. «Привлечение пирролизидиновых алкалоидов, ищущих чешуекрылых, к орхидеям Epidendrum Paniculatum ». Биотропика 22: 290–297.
Фенстер, С. Б. и С. Мартен-Родригес. 2007. «Репродуктивное обеспечение и эволюция специализации опыления». Международный журнал наук о растениях 168: 215–228.
Гейл, С. 2007. «Автогамное завязывание семян орхидеи, находящейся под угрозой исчезновения, в Японии: исследования опыления для сохранения Nervilia nipponica ». Систематика и эволюция растений 268: 59–73.
Госс, Г. Дж. 1973. «Биология опыления Orchidaceae: Polystachia flavescens , Epidendrum difforme и Eulophia alta из южной Флориды; Encyclia gracilis , Encyclia altissima и Encyclia rufa из Грейт-Инагуа, Багамы». Магистерская диссертация, Атлантический университет Флориды.
Магистерская диссертация, Атлантический университет Флориды.
Хоксвуд, Т.Дж. и Дж.Р. Тернер. 2004. «Наблюдения за Metriorrhynchus rhipidius (Macleay) (Coleoptera: Lycidae), питающимся нектаром цветов Leucopogon muticus R. Br. (Epacridaceae) в Кентерсте, Новый Южный Уэльс, Австралия». Калодема 2: 8–10.
Джонсон, Т. Р., С. Л. Стюарт, П. Каут, М. Э. Кейн и Н. Филман. 2009 г.. «Опровержение предположений о спонтанной автогамии в популяциях Eulophia alta (Orchidaceae) в южной Флориде: оценка влияния обработки популяции на формирование семян, прорастание семян и развитие сеянцев». Ботанический журнал Линнеевского общества 161: 78–88.
Королевский ботанический сад Кью. 2013. «Почему мы должны изучать орхидеи?» Королевский ботанический сад Кью. http://www.kew.org/science/orchids/whystudy.html?words=Breivik (апрель 2015 г.)
Крицкого, Г. 1991. «Предсказание Дарвина о мадагаскарском бражнике». Американский энтомолог 37: 206–210.
Ленебах, К.А. и А.В. Робертсон. 2004. «Экология опыления четырех эпифитных орхидей Новой Зеландии». Анналы ботаники 93: 773–781.
Micheneau, C., J. Fournel, B.H. Warren, S. Hugel, A. Gauvin-Bialecki, T. Pailler, D. Strasberg, et al. 2010. «Orthoptera, новый отряд опылителей». Annals of Botany 105 (3): 355–364, doi: 10.1093/aob/mcp299.
Ньюман, Э., Б. Андерсон и С. Д. Джонсон. 2011. «Адаптация окраски цветка у миметической орхидеи». Труды Королевского общества B: Biological Sciences 279: 2309–2313.
Rasmussen, HN 1995. Наземные орхидеи от семян до микотрофных растений . Кембридж, Великобритания: Издательство Кембриджского университета.
Робертс Д.Л. и К.В. Диксон. 2008. «Орхидеи». Текущая биология 18: 325–329.
Scopece, G., S. Cozzolino, S.D. Johnson, and F.P. Schiestl. 2010. «Эффективность опыления и эволюция специализированных систем обманного опыления». Американский натуралист 175: 98-105.
Сигел, К. 2011. «Орхидеи и колибри: секс на обгонах». Дайджест орхидей 75: 8–17.
Statman-Weil, Z. 2001 . « Aedes communis : Комар-опылитель». Лесная служба США. https://www.fs.usda.gov/wildflowers/pollinators/pollinator-of-the-month/aedes_communis.shtml (февраль 2023 г.)
Stökl, J., J. Brodmann, A. Dafni, M. Ayasse и B.S. Hansson. 2011. «Пахнет тлей: цветы орхидеи имитируют феромоны тревоги тли, чтобы привлечь журчалок для опыления». Труды Королевского общества B: биологические науки , doi:10.1098/rspb.2010.1770.
Wong, B.M. and F.P. Schiestl. 2002. «Как орхидея вредит своему опылителю». Труды Лондонского королевского общества B 269: 1529–1532.
Публикация #ENh2260
Дата: 10.04.2018
- Вендраме, Вагнер А.
- Рэй, Хейли А. 0
Тропический REC
СВЯЗАННЫЕ ТЕМЫ
- Биология растений
- Орхидеи
- Критический вопрос: сельскохозяйственные и продовольственные системы
Об этой публикации
Этот документ является ENh2260, одна из серии Департамента экологического садоводства, UF/IFAS Extension .