Нейтрализация уксусной кислоты: Чем можно нейтрализовать уксусную кислоту в случае разлива или аварии
Чем можно нейтрализовать уксусную кислоту в случае разлива или аварии
Химическая реакция нейтрализации представляет собой реакцию между щелочью и кислотой в результате которой образуется какая-то соль и вода. Примером таких процессов может быть реакция нейтрализации между уксусной кислотой и гидроксидом натрия или соляной кислотой и едким натрием.
Наблюдать реакцию нейтрализации кислоты щелочью можно только в том случае, если самого начала к раствору кислоты добавить индикатор, чтобы изменить окраску раствора. А как только к такому цветному раствору добавить щелочь, окраска сразу же исчезнет – будет выглядеть как фокус.
Как нейтрализовать уксусную кислоту гидроксидом натрия?
Для любой кислоты обязательно характерна реакция полной нейтрализации. В качестве доказательства этого можно провести эксперимент нейтрализации гидроксидом натрия уксусной кислоты. Для этого необходимо взять специальные химические колбы и наполнить их разбавленными растворами гидроксида натрия (NaОН) и уксусной кислоты (СН3 СООН).
После этого в бюретку необходимо аккуратно налить раствор уксусной кислоты. Затем в раствор щелочи по одной капле добавляется кислота. Это продолжается до того момента, пока весь гидроксид натрия не перейдет в соль. Полный переход будет виден по окраске ранее добавленного индикатора – фенолфталеина. Как только вся щелочь полностью прореагирует с образовавшейся солью ацетата натрия – малиновый цвет раствора исчезнет и жидкость будет прозрачной.
Современный способ нейтрализации уксусной кислоты.
На сегодняшний день в случае аварий и проливов на производствах используется способ нейтрализации уксусной кислоты на фасовочно-укупорочной автоматизированной машине. Осуществляется обработка поверхности, где была разлита уксусная кислота, безводным порошкообразным карбонатом натрия. Обработка кислоты ведется до образования густой пасты и паста не убирается.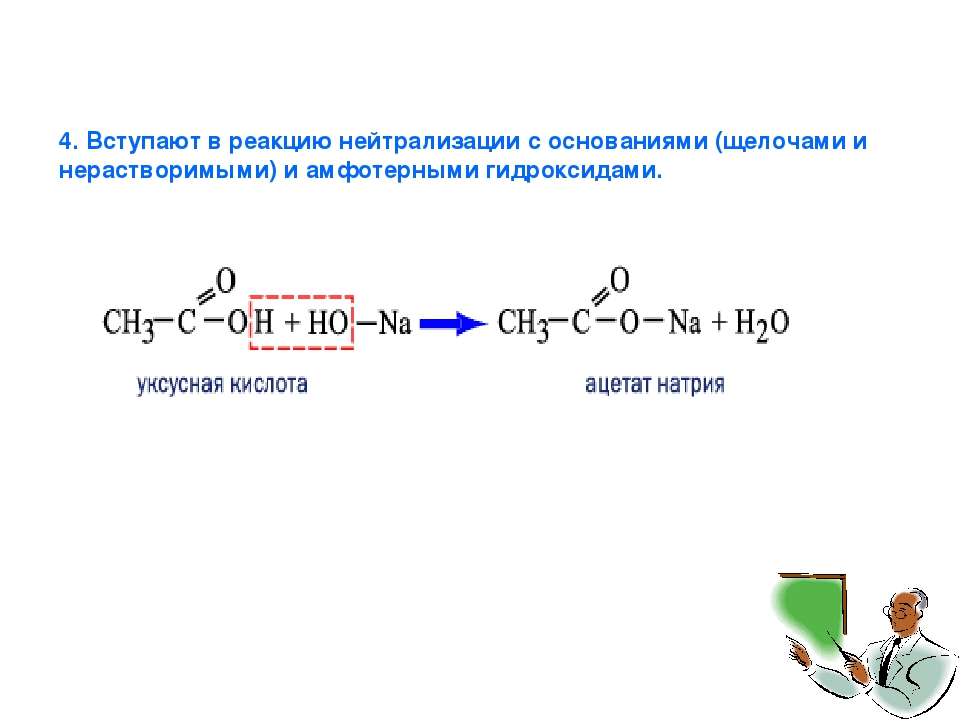
Если остается открытый вопрос чем можно нейтрализовать уксусную кислоту, то это может быть либо карбонат натрия, либо гидроксид натрия.
Обработка поверхности карбонатом натрия в случае первого разлива выполняется при таком соотношении компонентов по общей массе: Na2CO3:Ch4COOH=1,6÷4,0:1. Такой способ нейтрализации обеспечивает значительное сокращение отходов всего технологического процесса, позволяет уменьшить выделение СО2 и позволяет снизить токсичность технологического процесса.
Также существуют способы нейтрализации кислоты и ее растворов водными растворами гидрокарбоната натрия с концентрацией 1-4%, или водными растворами гидроксида натрия с концентрацией 2,5-10%. Недостатком данных способов является очень большой расход раствора, и как следствие, большое количество сточной воды, которая содержит ацетат натрия. А такую воду обязательно нужно очистить перед сбросом. Кроме этого, недостатком является еще и выделение в атмосферу и рабочую зону диоксида углерода.
Недостатком данных способов является очень большой расход раствора, и как следствие, большое количество сточной воды, которая содержит ацетат натрия. А такую воду обязательно нужно очистить перед сбросом. Кроме этого, недостатком является еще и выделение в атмосферу и рабочую зону диоксида углерода.
Максимально близким по технической сущности и полученному результату является метод нейтрализации уксусной кислоты на фасовочно-укупорочной машине.
Место разлива вещества на поверхностях выше поддона и на самом поддоне нейтрализуется с помощью раствора карбоната натрия. В растворе образуется большое количество ацетата натрия. Процесс нейтрализации контролируется при помощи устройства, определяющего уровень рН. Недостатком такого способа является также большое количество сточных вод с повышенной концентрацией ацетата натрия. Это приводит к тому, что для реализации выделения ацетата натрия нужна сложная технология, которая включает в себя кристаллизацию, выпаривание и фильтрование.
Задача этого устройства – сокращение отходов всего технологического процесса, сокращение расхода нейтрализующего агента, сокращение уровня выделения СО2, а также уменьшение токсичности.
Эта задача достигается тем, что в методе нейтрализации водных горючих растворов кислоты на фасовочно-укупорочной автоматизированной линии, включающем дополнительную обработку поверхности, на которую была разлита кислота, порошкообразным карбонатом натрия до образования пасты и ее не убирают.
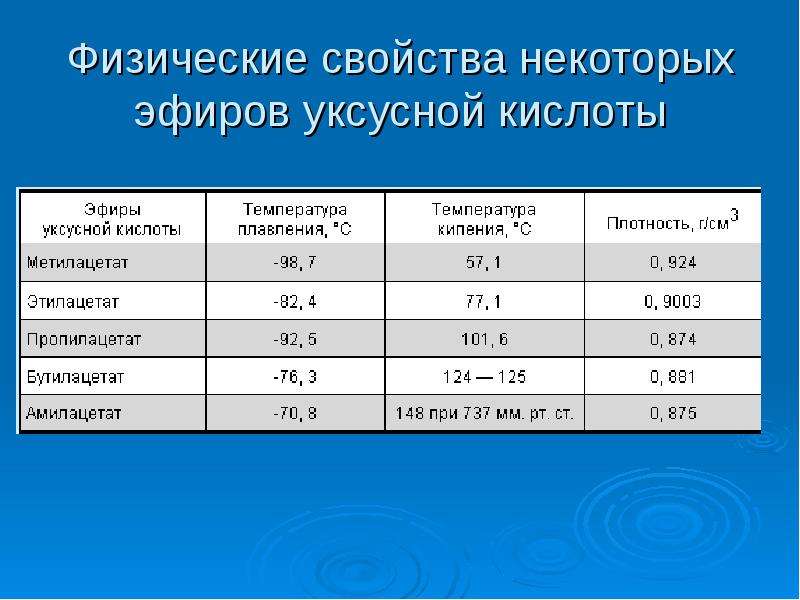
Автоматизированная фасовка и укупоривание выполняется на модифицированной фасовочно-укупорочной машине Б3-ОД-2-К/3-02/03/ по ТУ 3-1768.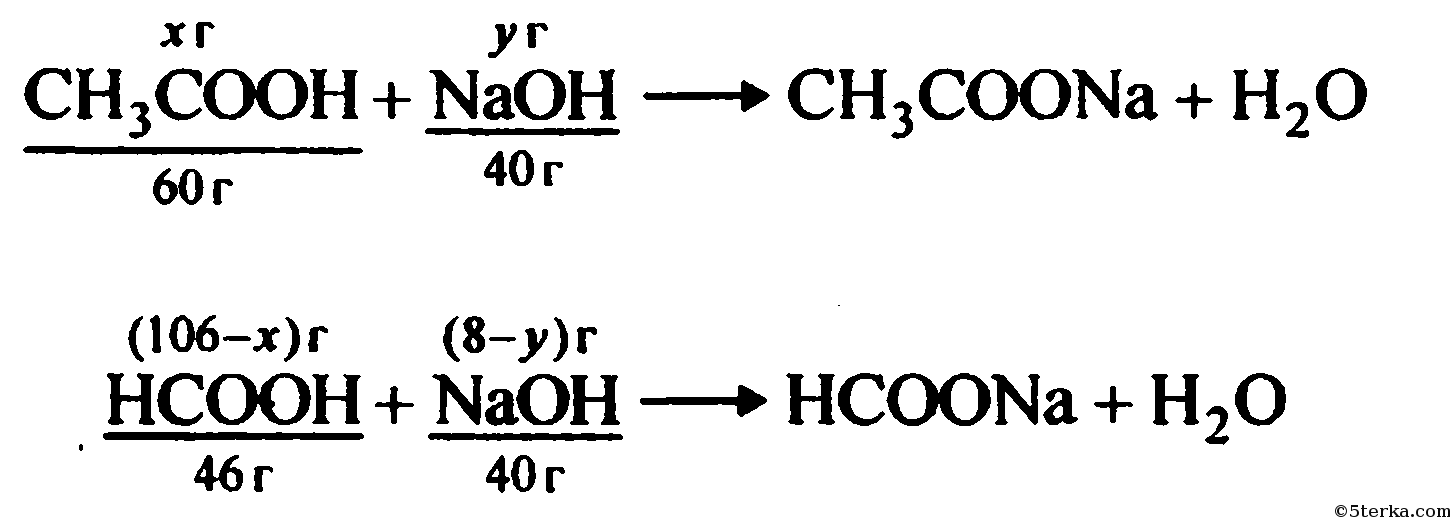 Данная машина предназначена для реализации фасовки 70-80%-ной уксусной кислоты в вакууме. Машина представляет собой автоматизированную систему ротационного типа с электроприводом, включающую специальный бункер полиэтиленовых пробок, карусели для укупоривания и фасовки. Максимальная мощность электропривода – 2,6 кВт. Основная часть уксусной кислоты выливается на поверхность поддона из нержавеющей стали, некоторая часть может попасть на поверхность вне поддона.
Данная машина предназначена для реализации фасовки 70-80%-ной уксусной кислоты в вакууме. Машина представляет собой автоматизированную систему ротационного типа с электроприводом, включающую специальный бункер полиэтиленовых пробок, карусели для укупоривания и фасовки. Максимальная мощность электропривода – 2,6 кВт. Основная часть уксусной кислоты выливается на поверхность поддона из нержавеющей стали, некоторая часть может попасть на поверхность вне поддона.
Поэтому если на своем предприятии вы не знаете, чем нейтрализовать уксусную кислоту, тогда данная система будет идеальным вариантом. На сегодняшний день это наиболее современный способ, который активно набирает популярность на различных предприятиях, занимающихся производством уксусной кислоты.
Ожог уксусом 70 🥝 что делать, как убрать кислоту, если переборщили в борще и заготовках
Автор Амира Иванова На чтение 10 мин. Опубликовано
C давних времен и по сей день, уксусная кислота является незаменимым помощником человека в кулинарии, медицине и в быту. Трудно представить кухню современной хозяйки без бутылочки уксуса или эссенции этого продукта. Однако неправильное обращение со столь опасным продуктом, может привести к неприятным последствиям, и испорченный вкус приготовленного блюда — это только “цветочки”, поэтому всегда нужно знать, чем нейтрализовать уксус.
Трудно представить кухню современной хозяйки без бутылочки уксуса или эссенции этого продукта. Однако неправильное обращение со столь опасным продуктом, может привести к неприятным последствиям, и испорченный вкус приготовленного блюда — это только “цветочки”, поэтому всегда нужно знать, чем нейтрализовать уксус.
Правила обращения с уксусом
Уксусная кислота была получена еще задолго до нашей эры. Некоторые исследователи утверждают, что для сохранения красоты и поддержания тонуса, известная всем Клеопатра пила напиток, в котором был разбавлен яблочный уксус.
Но сегодняшний уксус достаточно опасен для здоровья, ведь не зря на бутылках с продуктом пишут “Опасно для жизни”. Получить ожог уксусом очень легко, пролив его на открытый участок кожи, еще опаснее — попадание продукта внутрь.
Чтобы избежать подобных проблем, необходимо не забывать об элементарных правилах обращения с этим продуктом, и начинать исполнять их необходимо еще во время покупки, чтобы лишний раз не переживать:
- Покупайте только качественный продукт.
 Не забывайте, что уксусы бывают натуральными и синтетическими. Натуральный продукт вырабатывают уксусно-кислые бактерии в спиртсодержащих жидкостях, например, в незакрытом вине или в забродившем яблочном соке. Синтетический продукт был получен в 1898 году, а сегодня уксусная кислота вырабатывается из побочных продуктов производства химических удобрений или при сухой перегонке древесины. В нашей стране 90% продукта получают из остатков древесины, так что такой уксус лучше использовать в хозяйственных целях и в быту: для удаления накипи, ржавчины, клея и т. д. Например, в еде и заготовках маринованных грибов он не подойдет.
Не забывайте, что уксусы бывают натуральными и синтетическими. Натуральный продукт вырабатывают уксусно-кислые бактерии в спиртсодержащих жидкостях, например, в незакрытом вине или в забродившем яблочном соке. Синтетический продукт был получен в 1898 году, а сегодня уксусная кислота вырабатывается из побочных продуктов производства химических удобрений или при сухой перегонке древесины. В нашей стране 90% продукта получают из остатков древесины, так что такой уксус лучше использовать в хозяйственных целях и в быту: для удаления накипи, ржавчины, клея и т. д. Например, в еде и заготовках маринованных грибов он не подойдет. - Если вы открываете бутылку с уксусной кислотой, то никогда не нюхайте продукт у горлышка, не подносите бутылку близко к носу, чтобы не получить ожог дыхательных путей. Если вы хотите ощутить запах продукта, то помашите ладонью рядом с горлышком бутылки на расстоянии вытянутой руки так, чтобы запах дошел до вас.
- При использовании уксусной кислоты обязательно соблюдайте рекомендации и пропорции, указанные на упаковке, не нужно лить лишний раз.

- При приготовлении блюд, строго следуйте рецепту и не пренебрегайте нейтрализацией уксуса, чтобы не испортить вкус пищи и не увеличить кислотность желудка.
- Если вы используете уксусную кислоту в хозяйственных целях, то после ее применения обязательно проветривайте помещение. А чтобы нейтрализовать уксус, точнее его аромат, используйте поглотитель запахов, который часто применяют как средство для ухода за домашними животными, или используйте, для этой цели соль или соду.
Особенности повреждения кожи уксусной кислотой
Уксус относится к категории органических кислот, а ожог, полученный в результате попадания продукта на кожные покровы человека или слизистые оболочки, относится к разряду химических.
Все ожоги уксусной кислотой подразделяются на два основных вида:
- Внешний. В результате такого вида ожога, поражаются участки кожи или слизистые оболочки глаз, носа, рта потерпевшего.
- Внутренний ожог. В результате попадания уксусной кислоты внутрь, поражаются внутренние органы человека.

Первая помощь при внешнем ожоге
Чтобы избежать многих неприятных последствий, необходимо знать, как действовать в момент попадания агрессивного химического вещества на кожу. Чтобы помочь себе и другим пострадавшим и безопасно нейтрализовать уксус, используйте следующие рекомендации:
- Если химическое вещество попало вам на одежду, то сразу же снимите ее.
- Пораженное место интенсивно промойте проточной холодной водой.
Важно! Промывание должно быть обильным и продолжительным, не менее 20 минут. Кроме того, достаточно холодная вода уменьшит болевые ощущения.
Если вы оказываете помощь пострадавшему, то пока он промывает пораженный участок кожи, приготовьте слабый раствор соды или обычный мыльный раствор. Это — те средства, при помощи которых можно решить проблему, чем нейтрализовать уксус. Приготовленный раствором промойте ожог.
- Если уксус попал в глаза, то действуйте аналогично, в перерывах между промыванием глаз холодной проточной водой, используйте тщательно размешанный слабый содовый раствор.

- После тщательного промывания на пораженный участок кожи наложите влажный компресс, чтобы нейтрализовать остатки агрессивного химического вещества.
- Обожженное место обработайте антисептиком, и нанесите специальный препарат от ожогов, например “Рицинол” или “Пантенол”.
- На пораженный участок наложите свободную повязку так, чтобы она не сдавливала кожу и не доставляла дискомфорт и боль.
Важно! Если ожог достаточно серьезный, то сразу же обратитесь в больницу или вызовите скорую помощь. Специалисты окажут всю необходимую эффективную помощь и дадут необходимые рекомендации потерпевшему.
Первая помощь при внутреннем ожоге
Внутренний ожог намного опаснее внешнего, и может иметь достаточно плачевные последствия для потерпевшего. Если отравление 9% уксусом, как правило, проявляется химическим ожогом слизистой оболочки желудка, пищевода и ротоглотки, то отравление 70% уксусной эссенцией может закончиться летальным исходом.
При попадании агрессивного химического вещества в пищеварительный тракт человека, необходимо:
- безотлагательно промыть желудок и кишечник обычной водой;
Чем нейтрализовать кислоту в домашних условиях
Едкий натр — что это такое и с чем его едят? К какой группе веществ относиться и опасен ли при попадении на кожу? Чем нейтрализовать? Извините за незнание, химики, физика.
Так чем нейтрализовать? И почему эта гадость всю ерунду разъедает?
Кислотой.
Под ерундой ты что имеешь в виду?
Пластиковый слив в раковине и свой палец.
Сильные щелочи расщепляют жиры, денатурируют белки, рвут пептидные, эфирные связи.
Если нужно его вылить, то лучше нейтрализовать кислотой, а затем разбавить большим количеством воды.
Он в жидкости для промывания труб содержался. Так палец кислотой и водой спасть? Жжоться и воняет, сцуко.
не хватало еще кислоты на палец
промыть обильным количеством воды надо
Промыл уже, спасибо. Так чем эту щелочь в случае повторения ситуации нейтрализировать стоит? Помио воды?
Так чем эту щелочь в случае повторения ситуации нейтрализировать стоит? Помио воды?
Ну, если на себя, то водой. Если на что-то еще, то можно и кислотой сначала — лужа меньше будет
может уксусом плеснуть?
+1
Уксус самое оно для пальца. Не эссенцией, оф коз, а 9%-ным.
Для более деликатных органов (слизистые и тп) лучше раствором
борной кислоты. Должна быть в аптечке, нет — купить в аптеке.
Не путать с бурой!
А остатки раствора можно перед выливанием нейтрализовать
тем же уксусом. Лучше с избытком.
Самый правильный ответ.
Общее правило: действовать нейтрализующим агентом, но мягким (разбавленным).
Исключение — глаза.
—
. Я работаю.
> Исключение — глаза.
В общем, с головой надо дружить.
—
. Я работаю.
если на кожу попала щелочь, промывают большим количеством воды, а потом борной кислотой, или слабой уксусной.
Как гласит инструкция по ТБ, попадание твёрдого NaOH в глаза приводит к полной слепоте.
Реально вы меня напугали. С щелочью теперь понятно все. А если кислотное средство куда-нибудь попадет? Его чем нейтрализовать?
борная кислота при попадании на кожу (это порошок) проблем не вызовет — водой смыть сразу, и все.
Меня больше интересую серная, азотная, хлорная и иже с ними.
При попадании на кожу кислот немедленно обмывают пораженное место обильным количеством воды, затем 3% раствором соды. После такой обрабоки пораженное место необходимо смазать подходящим средством от ожога и стерильно перевязать.
Спасибо! Таки и думал, что сода, но хотелась услышать авторитетное мнение.
Опытно проверено, что:
безводная серная кислота при попадании на кожу в течение:
5 сек — не вызовет ничего
15 сек — вызовет шелушение кожи через день
около минуты — труднозаживающий химический ожог (покраснение, возможно зуд на неделю).
дерево и бумагу — обугливает, хлопчатные ткани разрушает примерно за 5 сек. Сильный окислитель за счёт серы +6. Имеет слабый тяжёлый запах за счёт оксидов еры и испарения самого вещества.
Сильный окислитель за счёт серы +6. Имеет слабый тяжёлый запах за счёт оксидов еры и испарения самого вещества.
В некрепкой серной кислоте (20%) спокойно можно полоскать руки (но не слизистые оболочки! критические времена, с которых начинаются заметные поражения тут гораздо больше. Запаха почти не имеет.
На бумагу и ткани действует не так активно, но всё равно деструктивно: незаметная на первый взгляд капелька на метериале обернётся дыркой через несколько часов. Относительно слабенький окислитель за счёт Н+.
 В разбавленном виде окислитель примерно такой же, как серная в концентрированном проявляет слабые восстановительные свойства.
В разбавленном виде окислитель примерно такой же, как серная в концентрированном проявляет слабые восстановительные свойства. Азоточка имеет неприятную особенность: даже в малых концентрациях оставляет на коже жёлтые пятна, что связано с денатурацией белка с обазованием окашеных соединений. По вонючести стоит ниже солянки, но всё равно не шанель номер пять — резкий неприятный запах. Концентрированая (а того хуже — азеотропка или даже безводная) азотка очень опасна для человека: при попадании на кожу очень быстро (секунды!) оставляет глубокие ожоги.
При разбавлении растворов кислот (особенно серной!) следует иметь в виду, что этот процесс сопровождается большим тепловыделением. Поэтому, как учили в школе «сначала вода, потом кислота, иначе случится большая беда».
Во все указаные выше кислоты (кроме азотной с концентрацией выше 30%) можно сунуть на палец без больших проблем для здоровья (в азотке он пожелтеет, правда если потом его тщательно промыть под краном, после чего вымыть обычным мылом.
 Не следует забывать, что при попадании даже разбавленных растворов кислот даже на маленькие ранки вы почувствуете в месте ранки боль, примерно одинаковую для всех указаных кислот и пропорциональную кнцентрации кислоты.
Не следует забывать, что при попадании даже разбавленных растворов кислот даже на маленькие ранки вы почувствуете в месте ранки боль, примерно одинаковую для всех указаных кислот и пропорциональную кнцентрации кислоты. Абзац выше написан не в порядке пропаганды распиздяйства, а в порядке борьбы с фобиями. У большинства людей, почему-то, при слове «кислота» начинается лёгкая истерика.
И вообще, баян, инфы про первую помощь при хим. ожогах концентрироваными растворами кислот и щелочей где только нет.
Ну и по поводу едких щелочей напишу.
Едкий натр NaOH и едкое кали KO
Как избавиться от запаха уксуса с разных поверхностей
Уксус обладает хорошими очищающими и дезинфицирующими свойствами, поэтому его часто применяют в быту. Им обрабатывают различные поверхности, проводят уборку помещения, выводят пятна с одежды. Но, несмотря на свою уникальность, вещество оставляет после себя неприятный кисловатый аромат, который действует удушающее. Многие вещества способны быстро нейтрализовать уксусный запах, только нужно знать, как правильно их использовать и на каких поверхностях.
Свойства запаха и способы его устранения
Уксусный продукт получают микробиологическим способом: путем брожения жидкостей, на основе спирта, в которых развиваются уксуснокислые бактерии. Именно поэтому вещество имеет специфический запах. Свое применение в кулинарии, очистке поверхностей от патогенных микроорганизмов, плесени, грибков продукт нашел благодаря большому количеству уксусной кислоты, которая содержится в нем. Избавиться от его запаха не сложно, если небольшая часть вещества пролилась на пол. Помещение достаточно проветрить и помыть. Но что делать, если его пролилось много:
- Проветривание. Для быстрого устранения неприятного аромата необходимо создать сквозняк. Для этого открывают все окна, двери в помещении. Сколько должно длиться проветривание зависит от насыщенности запаха. В среднем понадобиться 2-4 часа. Процедуру проветривания возобновляют, если уксусный запах с первого раза устранить не получилось.
- Уборка с помощью моющих средств.
 В ведре воды растворяют жидкое средство для мытья посуды. Приготовленным раствором тщательно вымывают все полы. Если после их высыхания запах уксуса не исчезнет, полы промывают повторно. Чтобы запах исчез быстрее, можно воспользоваться ароматизированными моющими средствами или капнуть в воду несколько капель любого эфирного масла.
В ведре воды растворяют жидкое средство для мытья посуды. Приготовленным раствором тщательно вымывают все полы. Если после их высыхания запах уксуса не исчезнет, полы промывают повторно. Чтобы запах исчез быстрее, можно воспользоваться ароматизированными моющими средствами или капнуть в воду несколько капель любого эфирного масла. - Соль, пищевая сода. Эти вещества являются хорошими адсорбентами способными впитать в себя не только уксусный запах, но и другие неприятные ароматы. Соль и соду укладывают в емкости, затем расставляют их по помещению. Чтобы добиться лучшего эффекта, вещество заменяют новым каждых 2 дня.
Вирусологи рекомендуют обрабатывать уксусным раствором мойки, унитазы и их крышки, разделочные доски и другие проблемные зоны в квартире, чтобы уничтожить всех микробов. Поэтому не стоит спешить устранять аромат уксуса.
Удаление запаха с ковровых покрытий и мебели
Пролитый на ковер, мягкую мебель уксус быстро впитывается и источает ужасный запах, вывести который становится сложно. Есть несколько проверенных способов, помогающих от него избавиться:
Есть несколько проверенных способов, помогающих от него избавиться:
- Нашатырный спирт, стиральный порошок. Из стирального порошка готовят раствор: на 5 л воды понадобится 2 ст. ложки порошка, 1 ст. ложка нашатырного спирта. Все ингредиенты тщательно перемешивают. Приготовленным раствором обрабатывают ковер, диван так, чтобы изделия сильно не промокли. Для этого их нужно слегка протереть щеткой, затем влажной тряпкой и высушить феном.
- Сода. Уксусные пятна засыпают сухим порошком соды. Через 2-3 часа соду удаляют пылесосом.
- Моющее средство. Средство для мытья посуды капают на мягкую губку, вспенивают и обрабатывают ею пятна. Остатки пены снимают влажной салфеткой. Изделие высушивают феном. Также моющим средством можно заправить пылесос и обработать им мебельную обивку, ткани, ковры.
Чистка одежды и обуви
При выведении пятен и пота с одежды часто используют уксус, после которого любимая вещь начинает специфически пахнуть. Устранить едкий аромат можно разными методами:
Устранить едкий аромат можно разными методами:
- Плохо пахнущую вещь достаточно постирать в стиральной машине, применяя при этом ароматизированный порошок или кондиционер для стирки белья. Режим стирки подбирают в зависимости от свойства ткани, затем устанавливают режим «двойного полоскания». В основном такой метод чистки используют для хлопковой и синтетической одежды. И он сработает только в том случае, если запах уксуса был слабо выражен. Те же самые манипуляции проводят с обувными вещами, такими как балетки и тряпичные кеды.
- Деликатные ткани лучше очищать нашатырным спиртом. В емкость наливают большое количество воды, добавляют туда несколько капель нашатыря, тщательно размешивают. Одежду замачивают на 30 минут в приготовленном растворе, затем ее нужно прополоскать и повесить сушиться на балкон.
- Вещи, залитые уксусом, замачивают в водно-содовом растворе. Раствор должен быть сильной концентрации.
 Через 30 минут одежду прополаскивают в проточной воде и вывешивают на просушку.
Через 30 минут одежду прополаскивают в проточной воде и вывешивают на просушку. - Устранить запах уксуса с замшевой и кожаной обуви поможет раствор аммиака. Наружную и внутреннюю часть изделия нужно протереть салфеткой смоченной в аммиаке, затем протереть влажной губкой и отправить на просушку.
- Чтобы кроссовки перестали вонять, в них насыпают крупную соль. Через 12 часов ее тщательно вытряхивают. Если уксусный запах не исчез, процедуру повторяют.
Синтетические вещи могут полинять, поблекнуть после использования соды и нашатырного спирта, поэтому для такого вида вещей необходимо подбирать другой метод очистки.
Руки и волосы
Очистить волосы от уксусного запаха очень сложно. Такие адсорбенты, как сухая соль и сода не подходят. Можно попробовать промыть пряди волос лимонным соком, но его много не напасешься. Также уксус часто используют при приготовлении пищи. Его запах остается на руках и ни чем не смывается. Дезодоранты и мыло тоже помогают. Что делать:
Дезодоранты и мыло тоже помогают. Что делать:
- Руки. Соль наносят на руки, выжидают несколько минут, затем все смывают теплой водой. Не стоит использовать соль, если на коже рук имеются ранки, порезы, так как это приведет к сильному жжению. В этом случае заменить вещество сможет сок лимона, нашатырь, сода.
- Волосы. Для очистки волос необходимо приготовить щадящий содовый раствор: в 1 л. теплой воды нужно развести 5 ст. ложек соды. Волосы разделяют на пряди. Каждую прядь отдельно промывают детским мылом, затем наносят содовый раствор. Запах полностью исчезнет после первого же применения раствора.
Применение профессиональных нейтрализаторов
Если все народные методы были испробованы, а положительного результата нет, для устранения неприятных запахов используют бытовую химию. Она проста в использовании и обладает моментальным действием. Самые эффективные средства:
- Cristal. Средство продают в виде солевых кристаллов.
 Кристаллы располагают на участке с запахом и оставляют их там до тех пор, пока он полностью не исчезнет. Средство можно располагать не только в комнате, но и в холодильнике.
Кристаллы располагают на участке с запахом и оставляют их там до тех пор, пока он полностью не исчезнет. Средство можно располагать не только в комнате, но и в холодильнике. - Multi. Средство продается в виде спрея, позволяет устранять все органические ароматы. Предназначено для обработки любых видов поверхностей, в том числе для чистки одежды, мебели, ковровых покрытий.
- Allergy Free. Препарат полностью нейтрализует все неприятные запахи, позволяет поддерживать микрофлору в помещении на необходимом уровне. Благодаря таким свойствам рекомендуется к применению людям, страдающим аллергическими заболеваниями.
- OdorGone Animal Gold. Средство предназначено для устранения кошачьих и собачьих запахов, но его также успешно применяют для нейтрализации уксусного аромата. Загрязненное место достаточно обработать средством. Когда вещество полностью впитается, едкий запах уксуса исчезнет.
- Maroc Мечта.
 Препарат является поглотителем-уничтожителем запахов. Он не маскирует вонь, а полностью ее нейтрализует, одновременно ароматизируя воздух. Продукт используют в концентрированном виде либо добавляют небольшое его количество в моющее средство. При необходимости жидкость разводят с водой в соотношении 1:5-1:20, переливают в пульверизатор и обрабатывают им комнату.
Препарат является поглотителем-уничтожителем запахов. Он не маскирует вонь, а полностью ее нейтрализует, одновременно ароматизируя воздух. Продукт используют в концентрированном виде либо добавляют небольшое его количество в моющее средство. При необходимости жидкость разводят с водой в соотношении 1:5-1:20, переливают в пульверизатор и обрабатывают им комнату.
В основу всех нейтрализаторов запаха входят достаточно эффективные и безопасные средства. Но, несмотря на это они могут стать причиной серьезного раздражения рук, поэтому при их использовании необходимо соблюдать меры предосторожности и не допускать попадания средств на слизистые оболочки и кожу рук.
Полезные рекомендации
Уборка в домашних условиях с применением уксуса пройдет намного эффективнее, при соблюдении всех советов и рекомендаций. Основные правила:
- чтобы не пришлось долго выветривать уксусный запах, не стоит превышать дозировку продукта при его применении;
- не забывать после использования тщательно закручивать крышкой бутылку с уксусом;
- запах уксуса легко убирать с одежды и предметов, если вещество смывать через 15-20 минут после нанесения;
- обработанные продуктом вещи промывают большим количеством воды, до полного исчезновения уксусного запаха;
- во время обработки помещения, приготовления пищи с уксусом, необходимо надевать перчатки.

Хотя аромат уксуса достаточно устойчив и резок, устранить его не представляется сложным. Можно провести генеральную уборку, стирку, проветрить помещение и от неприятного запаха не останется и следа. Но стоит ли это делать, если средство обладает дезинфицирующими свойствами и является губительным для вирусов и большей части бактерий.
Как убрать кислоту из борща: проверенные способы
- Автомобили
- Бизнес
- Дом и семья
- Домашний уют
- Духовное развитие
- Еда и напитки
- Закон
- Здоровье
- Интернет
- Искусство и развлечения
- Карьера
- Компьютеры
- Красота
- Маркетинг
- Мода
- Новости и общество
- Образование
- Отношения
- Публикации и написание статей
- Путешествия
- Реклама
- Самосовершенствование
- Спорт и Фитнес
- Технологии
- Финансы
- Хобби
Рубрики
- О проекте
- Реклама на сайте
- Условия
- Конфиденциальность
- Вопросы и ответы
FB
Войти Висцеральный жир уходит при смене образа жизни. 4 вида жира и как их сбросить
4 вида жира и как их сброситьэксперты рассказали, почему не стоит его использовать
Уксус издавна считается средством, способным уничтожить практически все возможные микробы. Его часто используют как натуральный антисептик, считая, что это наиболее безопасное средство. Многим домохозяйкам еще их бабушки советовали добавлять уксус в воду при мытье полов или протирании пыли. В общем, это своего рода панацея.
Однако в современном мире действие этого чудо-средства ставят под сомнение, аргументируя это научными выводами.
Что такое уксус?
Данный продукт представляет собой раствор, основным компонентом которого является уксусная кислота. Это, конечно, знает каждый, что при разведении эссенции водой в определенной пропорции получается уксус, но с различным процентным значением.
Сама же кислота изготавливается двумя способами: путем перегона древесных материалов или же путем брожения винных напитков, меда или фруктов. В производственных масштабах в основном оба способа совмещают, получая недорогой и качественный продукт.
Чистота — залог здоровья
Благодаря повышенной кислотности уксус следует отнести к средствам, помогающим в решении вопросов чистоты. Это отличное средство для устранения накипи. Также ввиду свойств кислоты уксус способен расщеплять грязь.
Однако не стоит всецело надеяться только лишь на этот раствор. В особо загрязненных местах невозможно будет убрать должным образом, используя только лишь уксус. Сейчас огромный выбор всевозможных средств, которые крайне эффективно могут справиться с любым типом загрязнений. К тому же большинство современных очистителей имеют в своем составе дезинфицирующие компоненты.
Уксус и микробы
По официальным документам уксус не входит ни в один из перечней веществ как средство, способное дезинфицировать поверхности. Благодаря научным исследованиям доказано, что эффективная дезинфекция достигается путем обработки поверхностей растворами отбеливателей, а также растворами, содержащими спирты в подавляющем большинстве — от семидесяти процентов и выше.
Как применять при уборке дома
Стоит отметить еще раз, что в качестве дезинфекции, для борьбы с микробами и разного рода бактериями уксус не может использоваться как самостоятельное средство. Он может выступать лишь в качестве сопутствующего раствора при проведении домашних работ по уборке.
Если в определенное время нет возможности использовать профессиональные средства для очистки, то в качестве профилактической меры можно применить уксус. Его применение позволит очистить некоторые загрязненные участки.
Для очищения таких поверхностей, как полы, полки, столы или же окна, необходимо развести уксус в теплой воде, взяв оба компонента в равных частях.
Однако, если просто протереть им загрязненный участок, то это не даст абсолютно никакого результата, помимо резкого и стойкого запаха. Для возможного эффекта нужно обильно нанести раствор на поверхность и оставить в таком состоянии на тридцать-сорок минут. После этого времени необходимо удалить излишки воды и протереть все сухой тряпкой.
Обязательно стоит учесть перед уборкой, что уксусная кислота способна расщепить некоторые типы материалов. К таким видам относят чугун, натуральный камень, древесину и алюминий. Поэтому при уборке покрытий, изготовленных из этих материалов, уксус использовать не рекомендуется, иначе их можно повредить.
Антивирусный ажиотаж
В настоящее время при обострении ситуации с коронавирусом с полок магазинов исчезают не только определенные продукты, но и большинство дезинфицирующих и противомикробных средств. Уксусную кислоту тоже не обошли стороной паникующие покупатели.
Повышенный спрос на средства защиты от бактерий и вирусов привел к тому, что данный вид товара стал дефицитом. Люди, поддаваясь панике, стараются обезопасить себя всеми возможными способами. Но какова роль уксуса в этой борьбе?
Вирусы против уксуса
Несколько лет назад был проведен ряд исследований и экспериментов, по результатам которых было определено, что уксусная кислота способна противостоять вирусам гриппа и оказывает губительное действие на те виды бактерий, которые вызывают туберкулез.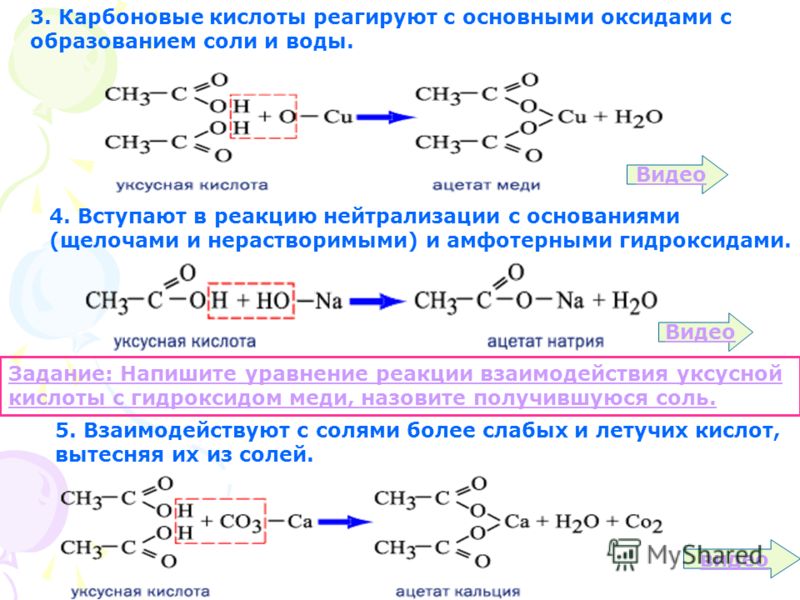 Но не стоит всецело опираться только лишь на эти выводы.
Но не стоит всецело опираться только лишь на эти выводы.
Как показала медицинская практика последних лет, вирусы способны адаптироваться к новым условиям, а впоследствии даже мутировать в более сложные штаммы. Кажется, что ученые, не успев изучить одну группу вирусов, сталкиваются с более сложными. Зачастую лекарственные средства, произведенные с целью уничтожения бактерий и вирусов, вызывающих определенные заболевания, в скором времени оказываются малоэффективны. Так что же говорить о таком простом продукте, как обыкновенный уксус?
Врачи-инфекционисты утверждают, что простой раствор семидесятидвухпроцентного хозяйственного мыла обладает большими дезинфицирующими, свойствами нежели уксусный раствор.
Именно поэтому даже в борьбе с разразившейся пандемией современного общества — коронавирусом врачи советуют как можно чаще обрабатывать поверхности именно мыльным раствором. Но это лишь в качестве подготовительного этапа. Основная роль по дезинфекции по-прежнему отведена отбеливающим средствам и спиртосодержащим растворам.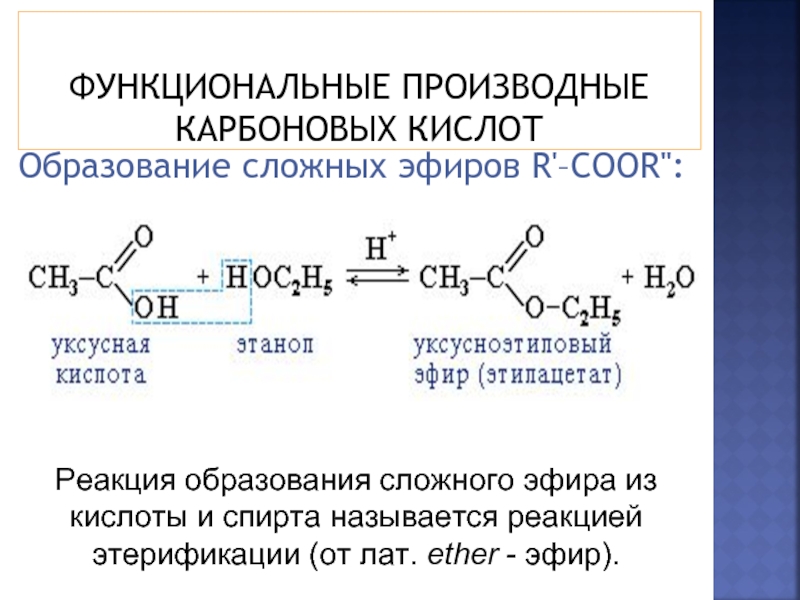
Живите настоящим, не всегда «бабушкины рецепты» дают нужный результат. Ведь в то далекое время, когда все спасались уксусной кислотой, не было такого разнообразия средств гигиены, как существует сейчас, и приходилось пользоваться тем, что было более или менее доступно простому человеку. А уксус лучше оставить на кухне, чтобы использовать его по самым приятным поводам — при приготовлении вкусных блюд.
Нашли нарушение? Пожаловаться на содержание
Анализ производства индол-3-уксусной кислоты (ИУК) в …
Аннотация
Многие ризобактерии, выделенные из ризосферы растений, продуцируют различные фитогормоны в виде вторичных метаболитов, наиболее распространенным из которых является индол-3-уксусная кислота (ИУК). Здесь мы подробно описываем аналитические протоколы обнаружения и количественного определения ИУК, in vitro, и in situ, , недавно примененного к Klebsiella SGM 81, ризобактерии, выделенной из ризосферы Dianthus caryophyllus (коммерчески важный цветок в глобус). В частности, мы описываем подробный протокол колориметрического анализа с использованием метода реагента Сальковского, который может использоваться для скрининга на наличие соединений индола. Для дальнейшего обнаружения и количественного определения ИУК используется высокоточный аналитический подход ЖХ-МС / МС. Для выявления присутствия ИУК вокруг корневой системы Dianthus caryophyllus , in situ окрашивание корней растений проводится с использованием реактива Сальковского.
В частности, мы описываем подробный протокол колориметрического анализа с использованием метода реагента Сальковского, который может использоваться для скрининга на наличие соединений индола. Для дальнейшего обнаружения и количественного определения ИУК используется высокоточный аналитический подход ЖХ-МС / МС. Для выявления присутствия ИУК вокруг корневой системы Dianthus caryophyllus , in situ окрашивание корней растений проводится с использованием реактива Сальковского.
Ключевые слова: индол-3-уксусная кислота, Klebsiella , реактив Сальковского, ЖХ-МС / МС, триптофан, спектрофотометр
.Предпосылки
Бактериальный ауксин в форме индол-3 уксусной кислоты (ИУК) является продуктом L-триптофана, метаболизируемого бактериями (Lynch, 1985).Группа бактерий, известных как ризобактерии, способствующие росту растений (PGPR), специфически проживающие вблизи корней, зависят от присутствия триптофана в корневых экссудатах растений (Кравченко и др. , 2004; Камилова и др. , 2006 ). Эти PGPR используют IAA как сигнал для взаимодействия с корнями растений и колонизации частей растений. Считается, что эта сигнальная особенность ИУК влияет на физиологию бактерий (Spaepen et al. , 2007).
, 2004; Камилова и др. , 2006 ). Эти PGPR используют IAA как сигнал для взаимодействия с корнями растений и колонизации частей растений. Считается, что эта сигнальная особенность ИУК влияет на физиологию бактерий (Spaepen et al. , 2007).
В литературе встречаются различные методы определения биосинтеза ИУК.Гордон и Вебер (1951) были первыми, кто предоставил колориметрический анализ с использованием реактива Сальковского для обнаружения ИУК. С тех пор этот метод широко используется для обнаружения ИУК в микроорганизмах. Реагент Салковского представляет собой смесь 0,5 М хлорида железа (FeCl 3 ) и 35% хлорной кислоты (HClO 4 ), которая при реакции с ИУК дает розовый цвет из-за образования комплекса ИУК и восстановления Fe 3+ . (Камнев и др. , 2001). Цвет, появляющийся при положительной реакции, указывает на присутствие различных соединений индола как продукта метаболизма триптофана.Помимо колориметрического анализа, другими методами оценки ИУК бактерий и растений являются высокоэффективная жидкостная хроматография (ВЭЖХ) (Perrig и др. , 2007), тандемная масс-спектрометрия с ионизацией электрораспылением (ЖХ-ЭСИ-МС / МС). (Chiwocha et al. , 2003) и с помощью высокоэффективной тонкослойной хроматографии HPTLC (Goswami et al. , 2015). Жидкостная хроматография (ЖХ) — предпочтительный подход для определения концентрации ИУК и подтверждения ее чистоты с высокой точностью и стандартизацией.ЖХ в сочетании с различными масс-спектрометрическими детекторами являются мощными инструментами для анализа IAA. Из-за высокой чувствительности и селективности масс-спектрометрические детекторы чаще всего сочетаются с ЖК. Одним из важных преимуществ ЖХ-МС является то, что анализ и разделение соединений могут выполняться непрерывно, исключая стадию очистки (Kallenbach et al. , 2009).
, 2007), тандемная масс-спектрометрия с ионизацией электрораспылением (ЖХ-ЭСИ-МС / МС). (Chiwocha et al. , 2003) и с помощью высокоэффективной тонкослойной хроматографии HPTLC (Goswami et al. , 2015). Жидкостная хроматография (ЖХ) — предпочтительный подход для определения концентрации ИУК и подтверждения ее чистоты с высокой точностью и стандартизацией.ЖХ в сочетании с различными масс-спектрометрическими детекторами являются мощными инструментами для анализа IAA. Из-за высокой чувствительности и селективности масс-спектрометрические детекторы чаще всего сочетаются с ЖК. Одним из важных преимуществ ЖХ-МС является то, что анализ и разделение соединений могут выполняться непрерывно, исключая стадию очистки (Kallenbach et al. , 2009).
Материалы и реагенты
- Наконечники для пипеток на 100-1000 мкл (Sigma-Aldrich)
- Штативы для пробирок (Sigma-Aldrich, каталожный номер: Z334146)
- Пробирки и крышки с завинчивающейся крышкой (Sigma-Aldrich, номер по каталогу: AXYSCT10MLS)
- Пробирка Pyrex 20 мл (Sigma-Aldrich, каталожный номер: CLS980016)
- Кварцевая УФ-кювета полумикроквадратная, 1.
 4 мл, пробка из ПТФЭ (Sigma-Aldrich, номер по каталогу: Z276707)
4 мл, пробка из ПТФЭ (Sigma-Aldrich, номер по каталогу: Z276707) - Стерильные шприцевые фильтры с размером пор 0,2 мкм (Fisher Scientific, номер по каталогу: 720-1230)
- Центрифужная пробирка с завинчивающейся крышкой, емкость 10 мл (Sigma-Aldrich, номер по каталогу: SIAL301NN10R)
- Серологические пипетки из стекла Pyrex, емкость 5 мл (Sigma-Aldrich, каталожный номер: Z653829)
- Янтарные бутылки для хранения (Sigma-Aldrich, Supelco, каталожный номер: 23230-U)
- Штамм Klebsiella SGM 81 (выделен из ризосферы Dianthus caryophyllus )
- Дистиллированная вода
- Питательный бульон (микробиологический класс) (Sigma-Aldrich, номер по каталогу: 70122-500G), его состав и конечный pH см. Ниже:
- FeCl 3 степени чистоты (Sigma-Aldrich, CAS: 7705-08-0)
- Хлорная кислота 70% (Sigma-Aldrich, CAS: 7601-90-3)
- Метанол (лабораторный) (Sigma-Aldrich, CAS: 67-56-1)
- HCl (класс ACS) (Sigma-Aldrich, CAS: 7647-01-0)
- L-триптофан (класс traceCERT) (Sigma-Aldrich, CAS: 73-22-3)
- Уксусная кислота ледяная (Sigma-Aldrich, CAS: 64-19-7)
- Этилацетат (безводный) (Sigma-Aldrich, CAS: 141-78-6)
- Индол-3-уксусная кислота (ИУК) (Sigma-Aldrich, CAS: 87-51-4)
- Среды Мурашиге и Скуга (Сигма-Олдрич)
- Ацетонитрил
- Формиат аммония
- CH 3 CN
- Муравьиная кислота
- Этанол
- Агароза
- Питательные среды (см.
 Рецепты)
Рецепты) - Реактив Сальковского (см. Рецепты)
Оборудование
- Шпатель (Thermo Fisher, каталожный номер: F36711-0012)
- Пипетка Nichipet Eco, объем 100-1000 мкл (Sigma-Aldrich, номер по каталогу: Z710199)
- Измерительный цилиндр (Sigma-Aldrich, каталожный номер: Z324361-2EA)
- Коническая колба 250 мл (Sigma-Aldrich, каталожный номер: Z723088-1EA)
- Ротационный вакуумный испаритель (тип Buchhi) (Jain Scientific Glass, 1188)
- Баланс
- Система Agilent 1100 LC и ABSciex 6500 Qtrap MS [Хроматография была на колонке Phenomenex Luna C18 (100 мм x 2 мм x 3 мкм)]
- УФ-спектрофотометр (Systronics, 166)
- Микроцентрифуга (Thermo Scientific, Pico 17)
- Магнитная мешалка (Remi, 1 MLH)
- Циклический смеситель Vortex (Remi, CM 101)
Программного обеспечения
- Аналитик 1.6.1 (AB Sciex)
Процедура
- Скрининг и количественное определение ИУК из Klebsiella SGM 81 с использованием метода реагента Сальковского
- Подготовка культуры
- Возьмите среду для предварительного культивирования (без триптофана) и засевайте ее одной колонией штамма SGM 81 или полной петлей глицеринового исходного штамма.

- Инкубируйте засеянную прекультурную среду при 30 ° C, 120 об / мин в течение ночи. В результате будет получена молодая культура штамма Klebsiella SGM 81, которая может быть использована для инокуляции производственной среды IAA (тестовой среды).
- Добавьте 100 мкл молодой культуры в тестовую среду и встряхните, чтобы получить однородную суспензию.
- Инкубируйте его в темноте (обернув контейнер газетой / алюминиевой фольгой) при 30 ° C и встряхивании при 120 об / мин.
- Инкубация длится 24-96 ч в темноте в зависимости от способности штамма продуцировать ИУК. Klebsiella SGM 81 производит IAA до 72 часов, после чего зарегистрировано последующее снижение производства.
- Возьмите среду для предварительного культивирования (без триптофана) и засевайте ее одной колонией штамма SGM 81 или полной петлей глицеринового исходного штамма.
- Количественное определение индола с использованием реактива Сальковаски
- Через 24 часа возьмите 1,5 мл бульона с культурой и перенесите его в пробирку Эппендорфа.
- Центрифуга при 16 278 x g в течение 5 мин с использованием микроцентрифуги.

- Осторожно удалите 1 мл супернатанта и перенесите в новую пробирку.
- Смешайте равный объем (1 мл) реагента Сальковского, осторожно перемешайте на вортексе и инкубируйте реакционную смесь при 30 ° C в темноте в течение 30 мин.
- В новой пробирке замените супернатант 1 мл контрольной неинокулированной среды и смешайте с 1 мл реагента Сальковского. Это пустое место.
- Присутствие ИУК определяется путем измерения развития розового цвета через 30 мин (некоторые штаммы могут иметь красный цвет, как показано на рисунке 1).
Рис. 1. Развитие окраски в результате реакции Индола-Сальковского. A. Klebsiella SGM 81. B. SGM09. C. Контролировать незасеянные среды. - Используйте неинокулированную среду, чтобы установить бланк. Измерьте интенсивность цвета спектрофотометрически при 536 нм с помощью кюветы.
- Сравните оптическую плотность исследуемого образца со стандартной кривой IAA (10-100 мкг · мл -1 ), чтобы рассчитать концентрацию.

- Повторяйте процесс с аналогичными интервалами до тех пор, пока оптическая плотность не начнет уменьшаться, что укажет на прекращение производства ИУК.
- Подготовка культуры
- Анализ ИУК методом жидкостной хроматографии-масс-спектрометрии (LC-MS / MS)
- Подготовка проб
- Приготовьте 100 мл питательной бульонной среды с добавлением 0.5 г L-триптофана в колбе Эрленмейера на 250 мл.
- Добавьте 100 мкл молодой культуры в тестовую среду и встряхните, чтобы получить однородную суспензию.
- Инкубируйте его в темноте (обернув контейнер газетой / алюминиевой фольгой) при 30 ° C и встряхивании при 120 об / мин в течение 72 часов.
- Чтобы отделить клетки, центрифугируйте при 4 ° C в течение 20 мин при 2,800 x g и соберите 1000 мл супернатанта.
- Перенесите супернатант в стеклянную бутыль на 250 мл с завинчивающейся крышкой.Подкислите его, добавив 2-3 капли 1 н. Концентрированной HCl, чтобы достичь pH 2,5-3.

- Чтобы извлечь ИУК, добавьте двойной объем этилацетата к подкисленному супернатанту и энергично встряхните в течение 5 мин (в качестве альтернативы можно использовать делительную воронку). Дать смеси постоять при комнатной температуре 10 мин, чтобы получить верхний слой этилацетата. Используйте этот слой для дальнейшей обработки.
- В роторном испарителе установите температуру водяной бани равной температуре кипения этилацетата i.е. , 77,1 ° C (альтернативно, этилацетатную фазу можно сушить в вакууме на ротационном испарителе при 40 ° C). Время сушки системы растворителей зависит от объема пробы.
- Перенесите слой этилацетата в круглодонную колбу и отрегулируйте ее вращение, чтобы избежать ударов жидкой пробы. «Удар — это явление в химии, при котором однородные жидкости, кипяченные в пробирке или другом контейнере, будут перегреваться и при зародышеобразовании быстрое кипение вытеснит жидкость из контейнера (Википедия)». Это приведет к тому, что IAA выйдет из колбы в конденсатор трубка с круглодонной колбой.

- После полного испарения жидкого этилацетата чистая ИУК остается в кристаллической форме, прикрепленной к дну вращающейся колбы.
- Выключите все агрегаты роторного испарителя и снимите круглодонную колбу. Повторно растворите кристаллическую ИУК в 5 мл 20% метанола и храните при -20 ° C для дальнейшего использования.
- ЖХ-МС / МС анализ
- Отфильтруйте сохраненный метанольный экстракт (100 мкл), используя стерильные шприцевые фильтры 0.2 мкм, чтобы отделить нерастворимые частицы и более крупные соединения, если таковые имеются. Это образец для окончательного анализа.
- В качестве хроматографической системы используют колонку Phenomenex Luna C18 (2) (100 мм x 2 мм x 3 мкм) при температуре 50 ° C.
- Градиентная система растворителей от 10% растворителя A (2% ацетонитрила, 10 мМ формиата аммония, pH 4,2) до 90% растворителя B (94,9% CH 3 CN, 5% H 2 O, 0,1% муравьиной кислоты) является использовали для колонки более 10 мин при скорости потока 250 мл / мин.

- Промойте колонку 90% растворителем B в течение 3 минут, а затем повторно уравновесите 90% растворителем A в течение 6 минут.
- Используйте инъекции 10 мкл, чтобы загрузить образец для анализа.
- МС сконфигурирован с источником ионного привода Turbo Spray, в котором температура источника установлена на 500 ° C, а напряжение ионного распыления — на 5500 В.
- Анализируйте IAA с помощью мониторинга множественных реакций (MRM) в положительном режиме, используя переход 176> 130 с энергией столкновения 20 эВ.Переход 176> 130 означает конкретные пары значений массы к заряду (m / z), связанные с ионами-предшественниками и фрагментами. В нашем случае для Q1 установлено значение 176 а.е.м., а для Q3 — 130 а.е.м., энергия столкновения составила 20 мВ.
- Установите потенциал декластеризации, потенциал выхода и потенциал выхода ячейки столкновения на 30 В, 10 В и 10 В соответственно.
- Подготовка проб
- In situ Окрашивание по Сальковскому
- Приготовьте базальную солевую среду Мурашиге и Скуга (МСМ) с 0.
 8% агароза, без добавок растительных гормонов.
8% агароза, без добавок растительных гормонов. - Стерилизовать семена D. caryophyllus , используя трехступенчатую процедуру: 1-минутную промывку в 70% этаноле, затем 4-минутную промывку в 20% NaClO и заключительную промывку в стерильной дистиллированной воде 3 раза.
- Дайте семенам D. caryophyllus прорасти на среде MS, инкубируя чашки при 25 ° C в течение 14 часов света и 10 часов темноты в помещении для культивирования растений, пока длина корня не достигнет 2 см (приблизительно шесть дней).
- Обработайте проросшие корни растений, погрузив кончики корней в 5 мл бактериальной суспензии с титром 10 5 КОЕ мл -1 в универсальной пробирке.
- Перенести обработанные растения на новую среду агара MS, лишенную IAA и сахарозы, в квадратных чашках Петри (120 мм x 120 мм x 15 мм).
- Опять же, инкубируйте планшеты при 25 ° C в течение 14 часов света и 10 часов темноты в комнате для выращивания растений.
- Через две недели заражения окрашивайте обработанные корни реактивом Сальковского.

- Чтобы окрасить корни, добавьте 400 мкл реагента Сальковского на каждый корень и наблюдайте за любым видимым изменением цвета.
- Появление розового цвета, как показано на рисунке ниже, указывает на присутствие проксимальной IAA на и вокруг корней (Рисунок 2).
Рис. 2. In situ Окрашивание по Сальковски на корнях растений, обработанных Klebsiella SGM 81 из 10 5 КОЕ мл -1 титр
- Приготовьте базальную солевую среду Мурашиге и Скуга (МСМ) с 0.
Анализ данных
- Возьмите оптическую плотность образцов при 536 нм и графически рассчитайте концентрацию ИУК на основе стандартной кривой.Оценка ИУК из штамма Klebsiella SGM 81 с использованием реактива Сальковского показывает максимальный выход 215 мкг · мл -1 , обнаруженный через 72 часа с 0,15% триптофаном (рис. 1a в Gang et al. , 2018).
- Для анализа ЖХ-МС / МС подтверждение идентичности образцов выполняется с помощью сканирования с улучшенными ионами продуктов.

- Сбор и анализ данных выполняется с помощью Analyst 1.6.1 (AB Sciex).
- Количественная оценка проводится путем сравнения данных тестового образца с контрольным стандартом IAA.
- Перекрывающееся время удерживания во время ЖХ (5,90 мин и 5,92 мин) и идентичные отношения m / z (130,1) между коммерческим стандартом IAA и надосадочной жидкостью образца показали, что Klebsiella SGM 81 производит значительные количества (960 мкг · мл -1 через 72 часа). з) гомогенная ИУК (Gang et al. , 2018).
- Развитие розового цвета на корнях, обработанных Сальковски, указывает на присутствие бактериальной ИУК проксимальнее корней (рис. 3а в Gang et al., 2018).
Ноты
- Метод реагентов Сальковского, обсуждаемый в этой статье, показан с использованием жидкой среды питательного бульона (с добавлением L-триптофана), которая является неспецифической жидкой средой для большинства грамположительных и грамотрицательных бактерий.
 Однако можно использовать другие среды, такие как дрожжевой экстракт маннита (YEM), бульон Пиковской (с добавлением L-триптофана), если производство и количественное определение ИУК должно быть выполнено из Rhizobium или бактерий, солюбилизирующих фосфат, соответственно.
Однако можно использовать другие среды, такие как дрожжевой экстракт маннита (YEM), бульон Пиковской (с добавлением L-триптофана), если производство и количественное определение ИУК должно быть выполнено из Rhizobium или бактерий, солюбилизирующих фосфат, соответственно. - Предварительная подготовка культуры важна для нормализации начального количества клеток, особенно когда для процесса оптимизации проводится сравнительное исследование количественной оценки IAA.
- Реагент Сальковского позволяет количественно оценить общее содержание индола в образце. Чтобы получить чистоту и конъюгаты индол-3-уксусной кислоты (ИУК), можно использовать другие аналитические методы, такие как ВЭЖХ, ЖХ-МС / МС, ВЭТСХ и т. Д. .
Рецепты
- Питательные среды
- Используя мерный цилиндр, отмерьте 100 мл дистиллированной воды и перелейте ее в колбу Эрленмейера на 250 мл или стеклянную бутылку с завинчивающейся крышкой.Две другие колбы с той же средой, с триптофаном и без него, будут использоваться в качестве контрольной и предварительной среды (используемой для активации культуры SGM 81 для получения молодой культуры) соответственно.
- Для получения простой жидкой питательной бульонной среды взвесьте 1,3 г питательного бульона и растворите его в 100 мл дистиллированной воды. Тщательно перемешайте, чтобы порошок хорошо смешался с дистиллированной водой.
- Взвешивают 0,15 г L-триптофана (0,15% масс. / Об.) И добавляют в подготовленную колбу с питательным бульоном.Это жидкий питательный бульон с добавкой триптофана.
- Автоклавировать подготовленную среду при 121 ° C в течение 15 мин.
- Перед посевом дайте среде остыть и нагреться до комнатной температуры, чтобы гарантировать выживание посевного материала
- Используя мерный цилиндр, отмерьте 100 мл дистиллированной воды и перелейте ее в колбу Эрленмейера на 250 мл или стеклянную бутылку с завинчивающейся крышкой.Две другие колбы с той же средой, с триптофаном и без него, будут использоваться в качестве контрольной и предварительной среды (используемой для активации культуры SGM 81 для получения молодой культуры) соответственно.
- Реактив Сальковского
- 0,5 М 100 мл хлорида железа (растворить 8,125 г FeCl 3 в 100 мл дистиллированной воды)
- Чтобы разбавить доступную хлорную кислоту, отмерьте 24.5 мл (об. / Об.) Дистиллированной воды в мерный цилиндр и добавить в него 24,5 мл (об. / Об.) Концентрированной кислоты.
- Добавьте 1 мл (об. / Об.
 ) 0,5 М раствора хлорида железа в 49 мл 35% раствора хлорной кислоты.
) 0,5 М раствора хлорида железа в 49 мл 35% раствора хлорной кислоты. - Хорошо перемешайте и храните в темно-коричневой бутылке при комнатной температуре. Его можно использовать для дальнейших экспериментов, если хранить в описанных условиях.
Благодарности
Мы благодарны Министерству науки и технологий Индии за финансовую помощь в рамках стипендии INSPIRE на 2014-15 годы (IF 140042).Эта работа также была поддержана BBSRC (BB / 003608/1), Великобритания. В Имперском колледже Лондона мы благодарим Марка Беннета за помощь с анализом ЖХ-МС / МС. Протокол адаптирован из Gang et al. (2018).
Конкурирующие интересы
Мы заявляем об отсутствии конфликта интересов.
Рекомендации
- Чивоча, С. Д., Абрамс, С. Р., Амброуз, С. Дж., Катлер, А. Дж., Лёвен, М., Росс, А. Р. и Кермод, А. Р. (2003). Метод профилирования классов растительных гормонов и их метаболитов с использованием тандемной масс-спектрометрии с жидкостной хроматографией и электрораспылением с ионизацией: анализ гормональной регуляции термопараметрии салата ( Lactuca sativa L.
 ) семена. Завод J 35 (3): 405-417.
) семена. Завод J 35 (3): 405-417. - Ганг, С., Сараф, М., Уэйт, К. Дж., Бак, М. и Шумахер, Дж. (2018). Мутуализм между Klebsiella SGM 81 и Dianthus caryophyllus в модулировании пластичности корней и плотности ризосферных бактерий. Почва растений 424: 273-288.
- Гордон, С.А. и Вебер, Р.П. (1951). Колориметрическая оценка индолуксусной кислоты. Физиология растений 26 (1): 192-195.
- Госвами, Д., Таккер, Дж. Н. и Дхандукия, П. К. (2015). Одновременное обнаружение и количественное определение индол-3-уксусной кислоты (IAA) и индол-3-масляной кислоты (IBA), продуцируемых ризобактериями из 1-триптофана (Trp), с использованием HPTLC. J Microbiol Methods 110: 7-14.
- Калленбах М., Болдуин И. Т. и Бонавентура Г. (2009). Быстрый и чувствительный метод одновременного анализа алифатических и полярных молекул, содержащих свободные карбоксильные группы, в растительных экстрактах с помощью LC-MS / MS.
 Заводские методы 5: 17.
Заводские методы 5: 17. - Камилова, Ф., Кравченко, Л. В., Шапошников, А. И., Азарова, Т., Макарова, Н., Лугтенберг, Б. (2006). Органические кислоты, сахара и L-триптофан в экссудатах овощей, растущих на каменной вате, и их влияние на активность ризосферных бактерий. Mol Plant Microbe Interact 19 (3): 250-256.
- Камнев А., Щелочков А., Перфильев Ю. Д., Тарантилис П. А., Полисью М. Г. (2001). Спектроскопическое исследование взаимодействия индол-3-уксусной кислоты с железом (III). J Mol Struct 563: 565-572.
- Кравченко, Л., Азарова, Т., Макарова, Н., Тихонович, И. (2004). Влияние триптофана, присутствующего в экссудатах корней растений, на фитостимулирующую активность ризобактерий. Микробиология 73: 156-158.
- Линч, Дж. (1985). Происхождение, природа и биологическая активность алифатических веществ и гормонов роста в почве. В: Органическое вещество почвы и биологическая активность . Springer 151-174.

- Перриг, Д., Бойеро, М. Л., Мациарелли, О. А., Пенна, С., Руис, О. А., Кассан, Ф. Д. и Луна, М. В. (2007). Стимулирующие рост растений соединения, продуцируемые двумя агрономически важными штаммами Azospirillum brasilense , и их значение для рецептуры инокулянта. Appl Microbiol Biotechnol 75 (5): 1143-1150.
- Спапен, С., Вандерлейден, Дж. И Реманс, Р. (2007). Индол-3-уксусная кислота в передаче сигналов между микробами и микроорганизмами. FEMS Microbiol Ред. 31 (4): 425-448.
Просмотр полного текста
Скачать PDF
Вопросы и ответы
Авторские права: © 2019 Авторы; эксклюзивный лицензиат ООО «Биопротокол».
Синтезов P2P из фенилуксусной кислоты
Аннотация
Незаконный синтез фенил-2-пропанона (P2P) в подпольных наркологических лабораториях из фенилуксусной кислоты и уксусной кислоты.
ангидрид в присутствии ацетата натрия или пиридина, или от сухой перегонки фенилуксусной кислоты и ацетата свинца (II)
исследуется.Эти два пути исследуются с использованием капиллярной газовой хроматографии (ГХ) в сочетании с парофазной хроматографией Фурье.
трансформирующая инфракрасная (FTIR) спектроскопия и обнаружение масс-спектрометрии с электронным ударом (EIMS) (GC-EMR-EIMS), а также использование
спектроскопия ядерного магнитного резонанса (ЯМР) для выявления 21 побочного продукта реакции. Механизмы двух реакций
представлены P2P, а также механизмы, приводящие к возникновению этих побочных продуктов. Это расследование выявило
четыре реакционно-специфических соединения, которые можно использовать для различения двух методов синтеза.
Механизмы двух реакций
представлены P2P, а также механизмы, приводящие к возникновению этих побочных продуктов. Это расследование выявило
четыре реакционно-специфических соединения, которые можно использовать для различения двух методов синтеза.
Фиг.1
R 1 , R 2 = H — Амфетамин R 1 = H, R 2 = CH 3 — Метамфетамин
R 1 , R 2 = CH 3 — Диметиламфетамин
Фенил-2-пропанон (соединение 1 ), обычно называемый P2P, является промежуточным прекурсором при производстве
d, l-амфетамин, d, l-метамфетамин и другие подобные фенэтиламины (рис. 1 ). Его видное использование в
незаконное изготовление амфетамина и метамфетамина привело к тому, что правительство Соединенных Штатов контролирует
коммерческая продажа P2P в 1980 году ( 21 CFR 1308.12, Приложение II, 8501 ).
Однако планирование P2P не исключило незаконного изготовления амфетамина или метамфетамина этим путем. В самом деле, восстановительное аминирование P2P остается популярным синтетическим путем для подпольных химиков-фармацевтов. Разнообразие синтетические восстановительные пути в литературе, которые используют P2P для синтеза амфетамина или метамфетамина, были предмет недавнего обзора 1 .
Контроль над P2P серьезно ограничил его коммерческую доступность для подпольных химиков. Однако многие тайные химики изменили свои производственные схемы, синтезируя собственный P2P. Таким образом, P2P теперь незаконно производится из все же другие прекурсоры и имеют свою собственную подпольную рыночную стоимость. Текущие значения P2P в 1991 г., как сообщается, находятся между 1800 и 2000 долларов за литр.
Многие из описанных в литературе синтезов P2P приведены в Таблице 1 2-41 .Хотя все эти маршруты жизнеспособны, подпольное производство P2P сосредоточено на маршрутах 1A , 1B , 2 и 8A . Маршруты 1A и 1B имеют
преобладают в западной и северо-западной частях Соединенных Штатов и являются предметом данной статьи. Это авторы
цель этого исследования установить критерии, по которым эти два синтетических пути могут быть различены на основе
наличия или отсутствия конкретных побочных продуктов.Такая информация необходима судебному химику и
исследователь для установления соответствия между прекурсорами, примечаниями, отходами и готовым продуктом, полученным из
подпольная лаборатория; для подтверждения заявлений информаторов о подпольной лабораторной операции; и чтобы
прогнозировать возможные угрозы безопасности до захвата подпольной лаборатории.
Маршруты 1A и 1B имеют
преобладают в западной и северо-западной частях Соединенных Штатов и являются предметом данной статьи. Это авторы
цель этого исследования установить критерии, по которым эти два синтетических пути могут быть различены на основе
наличия или отсутствия конкретных побочных продуктов.Такая информация необходима судебному химику и
исследователь для установления соответствия между прекурсорами, примечаниями, отходами и готовым продуктом, полученным из
подпольная лаборатория; для подтверждения заявлений информаторов о подпольной лабораторной операции; и чтобы
прогнозировать возможные угрозы безопасности до захвата подпольной лаборатории.
Таблица 1
Синтезы P2P описаны в литературе.
| Маршрут | Прекурсоры и / или реагенты |
| 1 | Фенилуксусная кислота |
1A | Уксусный ангидрид 2-5 |
1B | Ацетат свинца (II) 6 |
1C | Оксид тория 7-10 |
1D | Ацетат бария (II) 11 |
1E | Ацетат кальция (II) 12 |
1 этаж | Карбонат марганца 13 |
1G | Оксид марганца 14,15 |
| 2 | α-фенилацетоацетонитрил 16-18 |
| 3 | α-фенил-β-метиленгликоль 19,20 |
| 4 | α-Фенилизопропиловый спирт 21 |
| 5 | Сложный эфир фенилацилмалоновой кислоты 22,23 |
| 6 | Фенилацетилхлорид 24,25 |
| 7 | α-метилстирол |
7A | Нитрат таллия 26 |
| 8 | β-метил-β-нитростирол |
8A | Fe, H + 27-31 |
8B | Никель Ренея 32 |
8C | Хлорид ванадия (II) 33 |
| 9 | Аллилбензол 34 |
| 10 | Фенилмагнийбромид 35 |
| 11 | Бензальдегид 36 |
| 12 | Бензол |
12A | Хлорацетон, хлорид алюминия 37,38 |
12B | Ацетон, Ацетат марганца (III) 39,40 |
12C | O, O-дипротонированный нитроолефин 41 |
Фиг. 2 [Увеличить]
2 [Увеличить]
Хроматограмма полного отклика (TRC)
Синтезировано
известных тайных образцов P2P
через Route 1B , используя ацетат свинца (II).
Пунктирными линиями обозначены регионы КИП.
, чьи соединения были произведены как побочные продукты
из помеченных конкурирующих реакций.
Экспериментальная процедура
Все образцы исследовали в режиме разделения (30: 1) на газовом хроматографе (ГХ) Hewlett-Packard Model 5980, оснащенном 12-м на 0.Капиллярная колонка из плавленого кварца с внутренним диаметром 32 мм, покрытая 0,52 м сшитого 5% фенилметилсиликона (HP-5, Hewlett-Packard Scientific Inc., Пало-Альто, Калифорния). Температурная программа печи была следующей: начальная температура 100 ° C; начальная задержка, 1 мин; скорость температурной программы 15С / мин; конечная температура 280 ° C; время окончательной выдержки 3 мин. Элюент из ГХ последовательно детектировали с помощью инфракрасной спектроскопии с преобразованием Фурье в паровой фазе (FTIR) (Hewlett-Packard, модель 5965a) и масс-спектрометрии с электронным ударом (ELMS) (HewlettPackard Model 5970).
Следующие соединения были получены от Aldrich Chemical Co: бензальдегид (соединение 29 ), метилбензоат ( 30 ), фенил-2-пропанон ( 1 ), бензилацетат ( 26 ), дифенилметан ( 28 ), бибензил ( 27 ), цис--стильбен ( 31 ), транс -стильбен ( 32 ) и дибензилкетон ( 2 ). Следующие соединения были синтезированы реакцией Гриньяра бензилбромида с P2P с последующей дегидратацией спирта уксусным ангидридом: E — и Z -1-фенил-2-метилаллилбензол ( 3 , 4 ) и 1,1-дибензилэтен ( 5 ).Основные продукты и изомерные отношения этой дегидратации были установлены с помощью экспериментов с ядерным магнитным резонансом (ЯМР) / ядерным усилением Оверхаузера (NOE) с последующим исследованием ГХ для установления порядка хроматографии. Это коррелировало соответствующие спектральные данные с соответствующим изомерным соединением. Соединения E — и Z -1,3-дифенил-2-метил-2-пентен-4-он ( 14 , 15 ), а также E — и Z -1, 5-дифенил-2-метил-1-пентен-4-он ( 10 , 11 ) синтезировали двумя разными способами: 42-44 .Продукты этих реакций исследовали с помощью GC-FTIR-EIMS и NMR-NOE, чтобы установить идентичность изомерных продуктов альдольной конденсации.
Соединения E — и Z -1,3-дифенил-2-метил-2-пентен-4-он ( 14 , 15 ), а также E — и Z -1, 5-дифенил-2-метил-1-пентен-4-он ( 10 , 11 ) синтезировали двумя разными способами: 42-44 .Продукты этих реакций исследовали с помощью GC-FTIR-EIMS и NMR-NOE, чтобы установить идентичность изомерных продуктов альдольной конденсации.
Результаты и обсуждение
Рисунок 2 представляет собой хроматограмму капиллярной ГХ-исследования незаконно произведенного P2P с использованием Route 1B . Эта полнопрофильная хроматограмма помечена скобками, указывающими на постулируемые механизмы, которые сформировали побочные продукты. Эти механизмы будут рассмотрены позже по тексту.Все компоненты были проверены капиллярной ГХ-элюцией в газофазный FTIR-детектор с последующим EIMS. Данные FTIR подклассифицировали компоненты как кетон (1710-1735 см -1 ), сложный эфир (1735-1770 см -1 ), формиловый эфир (17,35-1820 см -1 ), фенольный (3500-3600 см3). -1 ), α, β-ненасыщенный кетон (от 1650 до 1710 см -1 ), ароматический (от 670 до 790 см -1 ) и спа-гибридизированные двойные связи углерод-углерод (от 1540 до 1605 см — 1 ).Данные EIMS подклассифицировали компоненты на те, которые содержат ароматическое кольцо, присоединенное к гибридизированному углероду (заметная 91 m / z ), β-метилстирольная группа (заметная 117 m / z ) и β, β-диметилстирольная группа. (выпуклый 131 m / z ). Эти подклассы были проверены вручную, а также были автоматически извлечены с помощью программного обеспечения для обработки данных для создания селективных хроматограмм по длине волны из данных FTIR и хроматограмм одиночных ионов из данных EIMS.Известные тайные образцы P2P, синтезированные Route 1A или 1B , которые содержат большое количество компонентов, были исследованы инструментальными методами, а также подверглись классическим методам выделения. Химическое разделение проводили с помощью бисульфитно-аддитивного комплекса и реактива Жирара Т.
-1 ), α, β-ненасыщенный кетон (от 1650 до 1710 см -1 ), ароматический (от 670 до 790 см -1 ) и спа-гибридизированные двойные связи углерод-углерод (от 1540 до 1605 см — 1 ).Данные EIMS подклассифицировали компоненты на те, которые содержат ароматическое кольцо, присоединенное к гибридизированному углероду (заметная 91 m / z ), β-метилстирольная группа (заметная 117 m / z ) и β, β-диметилстирольная группа. (выпуклый 131 m / z ). Эти подклассы были проверены вручную, а также были автоматически извлечены с помощью программного обеспечения для обработки данных для создания селективных хроматограмм по длине волны из данных FTIR и хроматограмм одиночных ионов из данных EIMS.Известные тайные образцы P2P, синтезированные Route 1A или 1B , которые содержат большое количество компонентов, были исследованы инструментальными методами, а также подверглись классическим методам выделения. Химическое разделение проводили с помощью бисульфитно-аддитивного комплекса и реактива Жирара Т. Водная экстракция реакционных смесей бисульфатом натрия удаляла большую часть присутствующего P2P; однако высшие кетоны не так легко образуют бисульфитные аддукты из-за чувствительности добавок к стерическим препятствиям 45 .Водорастворимый продукт присоединения бисульфита-P2P может быть гидролизован сильной кислотой или основанием для регенерации P2P для исследования. Соединения, удерживаемые небисульфитом, реагировали с реактивом Жирара Т, материалом, который, как известно, реагирует с кетонами с образованием водорастворимых аддуктов, что позволяет разделить кетоновые и некетоновые соединения. Органическая экстракция позволила полностью выделить все некетоновые соединения в органическую фазу. Эти кетоновые и некетоновые соединения были ими. исследовано с помощью GC-FTIR-EIMS.
Водная экстракция реакционных смесей бисульфатом натрия удаляла большую часть присутствующего P2P; однако высшие кетоны не так легко образуют бисульфитные аддукты из-за чувствительности добавок к стерическим препятствиям 45 .Водорастворимый продукт присоединения бисульфита-P2P может быть гидролизован сильной кислотой или основанием для регенерации P2P для исследования. Соединения, удерживаемые небисульфитом, реагировали с реактивом Жирара Т, материалом, который, как известно, реагирует с кетонами с образованием водорастворимых аддуктов, что позволяет разделить кетоновые и некетоновые соединения. Органическая экстракция позволила полностью выделить все некетоновые соединения в органическую фазу. Эти кетоновые и некетоновые соединения были ими. исследовано с помощью GC-FTIR-EIMS.
Комбинация методов GC-FTIR-EIMS, водной бисульфитной экстракции и реактива Жирара Т в сочетании с изучением механизмов этих двух реакций позволила нам идентифицировать многочисленные примеси. Идентификация этих примесей была подтверждена альтернативным прямым синтезом, коммерческой покупкой или структурным анализом с помощью ЯМР-спектроскопии.
Идентификация этих примесей была подтверждена альтернативным прямым синтезом, коммерческой покупкой или структурным анализом с помощью ЯМР-спектроскопии.
Результаты спектрального анализа с помощью GC-FTIR-EIMS компонентов, представленных на хроматограмме на рис. 2 собраны и перечислены в таблицах, 2 и 3 .
Маршрут 1A, реакция фенилуксусной кислоты с уксусным ангидридом
Ключ к пониманию происхождения побочных продуктов и их идентичности был установлен в концепции механизмов, участвующих в реагирующей среде. Появилось несколько обзорных статей, касающихся возможного механизма реакции Дакина-Веста, декарбоксилирования α-ацилкарбоновой кислоты с образованием метилкетона 46,47 .Концептуально этот механизм можно разбить на несколько этапов (Рис. 3 ). Первый шаг — это кислотно-ангидридное равновесие. Второй этап — удаление протонов из активированного метиленового соединения (смешанный ангидрид) с помощью основания (ацетата натрия или пиридина). Третий этап — это воздействие карбанионом смешанного ангидрида на карбонильную группу уксусного ангидрида. Четвертая стадия — декарбоксилирование β-кетокислоты с образованием P2P (соединение 1 ). Этот пошаговый подход носит только концептуальный характер, поскольку есть свидетельства 46 , что механизм может включать циклический промежуточный продукт (рис. 4 ). Из рассмотрения фиг. 4 можно увидеть, что в зависимости от концентрации уксусного ангидрида по сравнению со смешанным ангидридом две молекулы смешанного ангидрида могут конденсироваться с образованием двух разных продуктов. Образующийся продукт зависит от того, ориентирован ли циклический промежуточный продукт «голова к хвосту» или «голова к голове». В переходном состоянии голова к голове генерируется дибензилкетон (соединение 2 ), который ранее был описан 5 . Из этого понимания механизма образования P2P и дибензилкетона можно сделать вывод, что если в реакции не используется избыток уксусного ангидрида, образование дибензилкетона будет благоприятным.
Третий этап — это воздействие карбанионом смешанного ангидрида на карбонильную группу уксусного ангидрида. Четвертая стадия — декарбоксилирование β-кетокислоты с образованием P2P (соединение 1 ). Этот пошаговый подход носит только концептуальный характер, поскольку есть свидетельства 46 , что механизм может включать циклический промежуточный продукт (рис. 4 ). Из рассмотрения фиг. 4 можно увидеть, что в зависимости от концентрации уксусного ангидрида по сравнению со смешанным ангидридом две молекулы смешанного ангидрида могут конденсироваться с образованием двух разных продуктов. Образующийся продукт зависит от того, ориентирован ли циклический промежуточный продукт «голова к хвосту» или «голова к голове». В переходном состоянии голова к голове генерируется дибензилкетон (соединение 2 ), который ранее был описан 5 . Из этого понимания механизма образования P2P и дибензилкетона можно сделать вывод, что если в реакции не используется избыток уксусного ангидрида, образование дибензилкетона будет благоприятным.
Еще одна группа примесей возникает в результате родственного механизма, называемого реакцией Перкина. 48-50 . Эти примеси возникают, когда концентрация P2P увеличивается и остаются значительные количества смешанного ангидрида [то есть недостаточное количество уксусного ангидрида для завершения третьей и четвертой концептуальных стадий реакции (рис. 3 )]. Реакция Перкина представлена на рис. 5 . Реакция инициируется активированным метиленовым соединением, которое конденсируется с карбонилом P2P.Эта конденсация приводит к внутримолекулярной циклизации с последующим декарбоксилированием-дегидратацией с образованием побочных продуктов: 3 , 4 и 5 . Соединения 6 и 7 , которые также образуются этим путем, могут присутствовать в незаконных образцах P2P.
Активные соединения метилена не ограничиваются смешанным ангидридом в этой реакционной смеси. В зависимости от концентрации и типа используемого основания (пиридин, ацетат натрия, ацетат кальция и так далее) P2P может стать источником карбаниона.Конденсация со второй молекулой P2P или другого карбонилсодержащего соединения приводит к образованию продуктов альдольной конденсации 51 . Эти кето-спирты подвергаются этерификации с последующим отщеплением уксусной кислоты (рис. 6 ) с образованием α, β-ненасыщенных кетонов, соединений 8 и 9 (кинетические продукты) и 14 и 15 . (термодинамические продукты), наряду с неконъюгированными кетонами 10 , 11 , 12 и 13 .В реальных реакционных смесях P2P были обнаружены только кетоны 12 , 13 , 14 и 15 . Это, скорее всего, является результатом условий реакции, которые благоприятствуют термодинамическому еноляту P2P и последующему переходному состоянию для дегидратации этих альдолов, что приводит к расширенному конъюгации в продуктах.
В зависимости от концентрации и типа используемого основания (пиридин, ацетат натрия, ацетат кальция и так далее) P2P может стать источником карбаниона.Конденсация со второй молекулой P2P или другого карбонилсодержащего соединения приводит к образованию продуктов альдольной конденсации 51 . Эти кето-спирты подвергаются этерификации с последующим отщеплением уксусной кислоты (рис. 6 ) с образованием α, β-ненасыщенных кетонов, соединений 8 и 9 (кинетические продукты) и 14 и 15 . (термодинамические продукты), наряду с неконъюгированными кетонами 10 , 11 , 12 и 13 .В реальных реакционных смесях P2P были обнаружены только кетоны 12 , 13 , 14 и 15 . Это, скорее всего, является результатом условий реакции, которые благоприятствуют термодинамическому еноляту P2P и последующему переходному состоянию для дегидратации этих альдолов, что приводит к расширенному конъюгации в продуктах.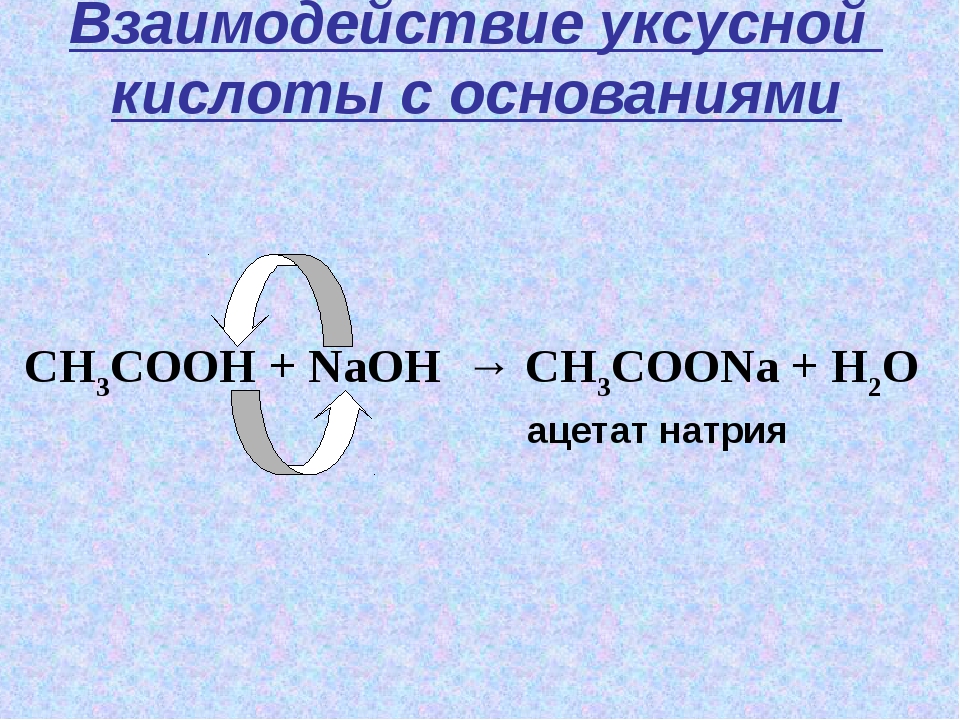 Для ясности и полноты спектральные данные FTIR и EIMS для соединений 10 и 11 , полученные в результате альтернативных синтезов, были включены в таблицу 2 и таблицу 3 .
Для ясности и полноты спектральные данные FTIR и EIMS для соединений 10 и 11 , полученные в результате альтернативных синтезов, были включены в таблицу 2 и таблицу 3 .
Конденсация третьей молекулы P2P с соединением 14 с последующей внутримолекулярной альдольной конденсацией-дегидратацией дает заметный побочный продукт Соединение 16 в основных условиях (фиг. 7 ). Подобная конденсация Соединения 14 с уксусным ангидридом дает Соединение 17 .
Другие конденсации активированных метиленовых соединений (то есть P2P и дибензилкетена) приводят к множеству побочных продуктов (соединения 18 , 19 , 20 , 21 и 22 ), показанных на рис. 8 . Кроме того, ситуация потенциально может стать еще более сложной, поскольку енолизуемые кетоны (рис. 4 ) этерифицируются уксусным ангидридом до их изомеров енолацетата E — и Z -. E — и Z — енолацетаты P2P (соединения 23 и 24 ), описанные Кизером, были обнаружены в этом исследовании как маркеры, определяющие путь реакции фенилуксусной кислоты и уксусного ангидрида с изготовление P2P.Механизм образования этих двух енолацетатов показан на фиг. 9 , а спектры парофазной FTIR и EIMS-спектры находятся на фиг. 10 и фиг. 11 , а также в таблице . 2 и Таблица 3 .
4 ) этерифицируются уксусным ангидридом до их изомеров енолацетата E — и Z -. E — и Z — енолацетаты P2P (соединения 23 и 24 ), описанные Кизером, были обнаружены в этом исследовании как маркеры, определяющие путь реакции фенилуксусной кислоты и уксусного ангидрида с изготовление P2P.Механизм образования этих двух енолацетатов показан на фиг. 9 , а спектры парофазной FTIR и EIMS-спектры находятся на фиг. 10 и фиг. 11 , а также в таблице . 2 и Таблица 3 .
Маршрут 1B, реакция фенилуксусной кислоты с ацетатом свинца (II)
Механизм реакции фенилуксусной кислоты и ацетата свинца (II) в литературе не описан. Циклическое переходное состояние, показанное на рис. 12 — одна из разумных возможностей. Шестичленный кольцевой интермедиат будет весьма предпочтительным и даст β-кетокислоту P2P, которая впоследствии декарбоксилируется до P2P. Литература
относительно окисления фенилуксусной кислоты ацетатом свинца (IV) подтверждает этот постулат 52,53 . Кроме того, из четырех охарактеризованных продуктов (фиг. 13 ) (соединения 25 , 26 , 27 и 28 ) в литературе 54 только бензилацетат ( 26 ), бибензил ( 27 ) и дифенилметан
( 28 ) были обнаружены в незаконных реакционных смесях P2P при синтезе через Route 1B .Бибензил ( 27 ) и дифенилметан ( 28 ) были обнаружены в этом исследовании как
соединения, специфичные для маршрута. Парофазные FTIR-спектры и EIMS-спектры этих двух соединений находятся на фиг. 14 и фиг. 15 , а также в таблице 2 и таблице 3 . В литературе указываются как механизмы переноса электрона, так и свободнорадикальные механизмы окисления фенилуксусной кислоты.
Литература
относительно окисления фенилуксусной кислоты ацетатом свинца (IV) подтверждает этот постулат 52,53 . Кроме того, из четырех охарактеризованных продуктов (фиг. 13 ) (соединения 25 , 26 , 27 и 28 ) в литературе 54 только бензилацетат ( 26 ), бибензил ( 27 ) и дифенилметан
( 28 ) были обнаружены в незаконных реакционных смесях P2P при синтезе через Route 1B .Бибензил ( 27 ) и дифенилметан ( 28 ) были обнаружены в этом исследовании как
соединения, специфичные для маршрута. Парофазные FTIR-спектры и EIMS-спектры этих двух соединений находятся на фиг. 14 и фиг. 15 , а также в таблице 2 и таблице 3 . В литературе указываются как механизмы переноса электрона, так и свободнорадикальные механизмы окисления фенилуксусной кислоты. кислота с ацетатом свинца (IV); оба пути могут быть задействованы в ацетате свинца (II).Перенос электрона может быть использован для рационализации образования P2P, в то время как свободнорадикальный механизм должен использоваться для рационализации образования бибензила и дифенилметана. При исследовании запрещенного P2P, синтезированного Route 1B , бензилфенилацетат ( 25 ) не был обнаружен. Дэвис и Уоринг 52 обнаружили, что при взаимодействии сравнимых количеств фенилуксусной кислоты и ацетата свинца (IV) основным образующимся радикалом является метильный радикал, приводящий к бензилацетату ( 26 ).Однако, если используется большой избыток фенилуксусной кислоты (8: 1), образование бензильного радикала, приводящего к бензилфенилацетату, благоприятно. Мы изучили инструкции, изъятые из подпольных лабораторий с использованием этого метода, и отметили, что они требуют небольшого молярного избытка ацетата свинца (II). Очевидно, что такое количество ацетата свинца (II) не способствует образованию бензилфенилацетата в Route 1B .
кислота с ацетатом свинца (IV); оба пути могут быть задействованы в ацетате свинца (II).Перенос электрона может быть использован для рационализации образования P2P, в то время как свободнорадикальный механизм должен использоваться для рационализации образования бибензила и дифенилметана. При исследовании запрещенного P2P, синтезированного Route 1B , бензилфенилацетат ( 25 ) не был обнаружен. Дэвис и Уоринг 52 обнаружили, что при взаимодействии сравнимых количеств фенилуксусной кислоты и ацетата свинца (IV) основным образующимся радикалом является метильный радикал, приводящий к бензилацетату ( 26 ).Однако, если используется большой избыток фенилуксусной кислоты (8: 1), образование бензильного радикала, приводящего к бензилфенилацетату, благоприятно. Мы изучили инструкции, изъятые из подпольных лабораторий с использованием этого метода, и отметили, что они требуют небольшого молярного избытка ацетата свинца (II). Очевидно, что такое количество ацетата свинца (II) не способствует образованию бензилфенилацетата в Route 1B .
Образование уксусного ангидрида in situ при нагревании ацетата свинца (II) будет приводить к побочным продуктам, идентичным продуктам, полученным через Route 1A описанными реакциями Дакина-Веста, Перкина и альдольной конденсации.
Выводы
Незаконный фенил-2-пропанон (P2P), синтезированный либо реакцией фенилуксусной кислоты с уксусным ангидридом в присутствии ацетата натрия или пиридина (Route 1A ), либо сухой перегонкой фенилуксусной кислоты и ацетата свинца (II) ( Маршрут 1Б ) изучен. Обсуждаются механизмы реакции для обоих путей, ведущих к целевому соединению и множеству побочных продуктов. Представлены данные парофазной FTIR и EIMS для этих соединений.Хотя это исследование установило многочисленные побочные продукты реакции, общие для этих двух маршрутов, были идентифицированы четыре специфических для маршрута соединения, которые могут быть использованы судебным химиком для различения этих двух маршрутов. Для Route 1A специфические для маршрута соединения идентифицированы как E — и Z — енолацетаты P2P, а для Route 1B специфические для маршрута соединения идентифицированы как бибензил и дифенилметан.
Для Route 1A специфические для маршрута соединения идентифицированы как E — и Z — енолацетаты P2P, а для Route 1B специфические для маршрута соединения идентифицированы как бибензил и дифенилметан.
Конспект лекции 9 + эксперимент 9: КИСЛОТНОЕ ТИТРОВАНИЕ
Эксперимент 9
Кислотно-основное титрование
ЦЕЛИ:
Изучить основные химические характеристики кислот и оснований.Чтобы узнать, как точно выполнять титрование Чтобы понять, как титры можно использовать в химическом анализе. Для приготовления и стандартизации раствора NaOH. Чтобы использовать ваш стандартизованный NaOH для определения молярности уксусной кислоты в уксус.
ВВЕДЕНИЕ:
Все химические лаборатории для первокурсников включают по крайней мере один эксперимент по титрованию.
Титрование — это старый и проверенный временем метод количественного анализа. 1 дюйм
при каждом титровании происходит какая-то реакция между парой
реагенты, А и Б.
Общий
Титрование m A + n B продукты титрования
Реакция
Реакция титрования обычно попадает в одну из трех следующих категорий:
(1) Реакция осаждения.
например AgNO 3 (водн.) + NaCl (водн.) AgCl (т.) + NaNO 3 (водн.)
(2) Кислотно-основная реакция.
например H 2 SO 4 (водн.) + 2 NaOH (водн.) 2 HOH (л) + Na 2 SO 4 (водн.)
(3) Реакция окисления-восстановления.
например 2 NaI (водн.) + Na 2 S 4 O 6 (водн.) I 2 (т. Е.) + 2 Na 2 S 2 O 3 (водн.)
В сегодняшнем эксперименте будет реакция типа (2) — реакция кислотно-щелочной нейтрализации.В виде всегда при титровании мы помещаем один реагент (раствор NaOH) в бюретку, а другой —
.1 Методы количественного анализа предназначены для ответа на количественные вопросы о том, сколько из
что-то присутствует в образце. Методы количественного анализа следует отличать от качественных.
Методы анализа, которые предназначены для ответа на качественные вопросы о том, какие вещества присутствуют в
образец.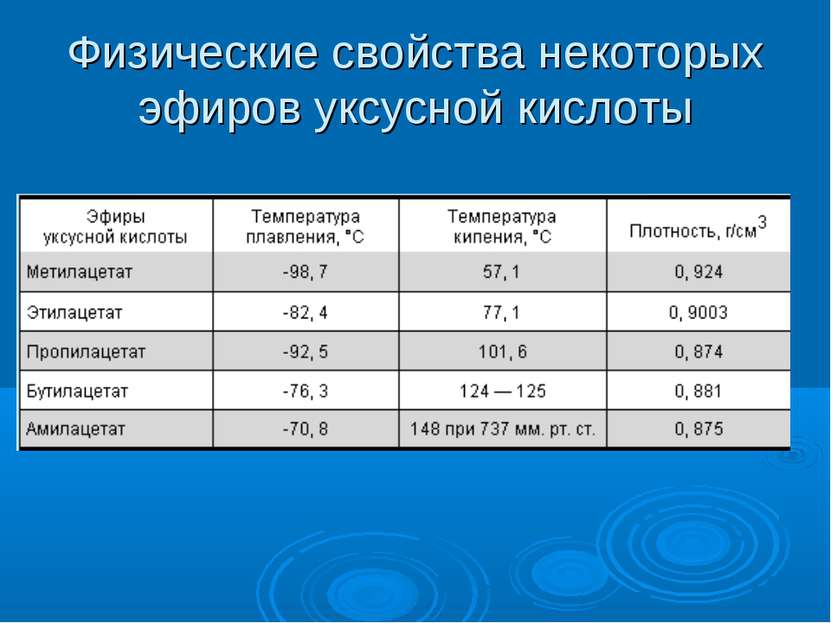
Стр. 2 из 10 Эксперимент № 9
Реагент(раствор кислоты) в колбе Эрленмейера.Затем мы осторожно добавляем NaOH к кислоте. пока мы не достигнем точки эквивалентности реакции. Это момент, когда мы добавили достаточно NaOH, чтобы точно реагировать с первоначальным количеством соляной или уксусной кислоты присутствует в колбе Эрленмейера.
Сегодняшняя HCl (водн.) + NaOH (водн.) HOH (l) + NaCl (водн.) Часть A Титрование Реакции HC 2 H 3 O 2 (водн.) + NaOH (водн.) HOH (л) + NaC 2 H 3 O 2 (водн.) Часть B
При реакции титрования необходимо иметь какой-либо индикатор, который сообщал бы нам, когда мы достигли
точка, в которой количества двух реагентов, присутствующих в колбе, химически эквивалентны
друг друга.2 В кислотно-щелочной реакции обычно используется органический краситель, цвет которого чувствителен к pH.
Мы будем использовать фенолфталеин в качестве индикатора в этом эксперименте, но если вы посмотрите в
В учебнике вы найдете ряд других индикаторных красителей. Собственно говоря, мы узнаем, как
выбрать лучший индикатор для кислотно-основного титрования во втором семестре этого курса.
Собственно говоря, мы узнаем, как
выбрать лучший индикатор для кислотно-основного титрования во втором семестре этого курса.
При каждом титровании добавляется несколько капель фенолфталеина. Фенолфталеин бесцветен в кислотный раствор, то есть исходный раствор кислоты в колбе Эрленмейера останется бесцветным когда индикатор добавлен.Однако фенолфталеин в основном растворе имеет розово-фиолетовый цвет. Этот означает, что пока в колбе присутствует ненейтрализованная кислота, когда капля NaOH остается добавлен, любой розовый цвет, который может образоваться первоначально, исчезнет, поскольку ОН-, ответственный за цвет находит ионы H + из кислоты и нейтрализуется. Однако, когда добавляется капля NaOH и H + больше нет, тогда в растворе останется розовый цвет. Когда розовый цвет сохраняется, мы прекращаем добавление раствора и говорим, что достигли конечной точки титрования.3
При кислотно-основном титровании стандартным раствором обычно является кислота или основание. Этот
означает, что мы знаем концентрацию этого раствора с большой точностью.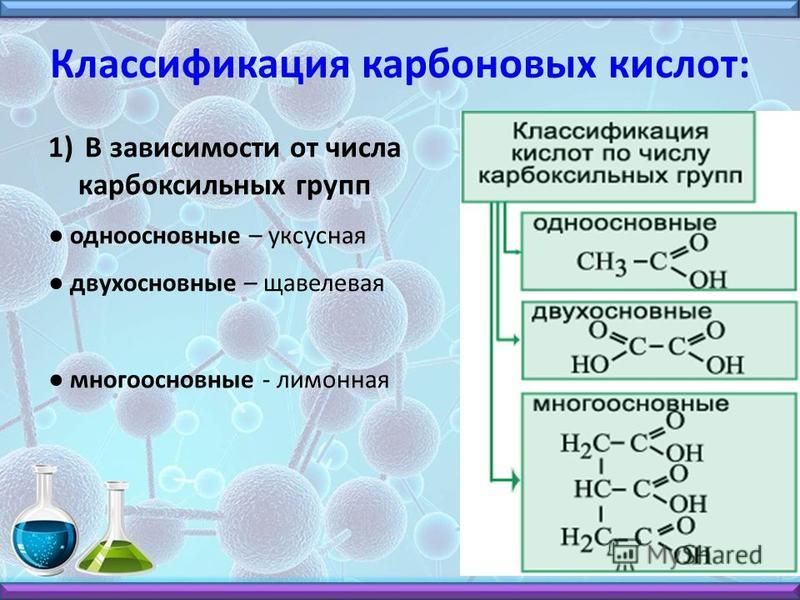 Другой
В образце обычно есть что-то неизвестное. Выполняя титрование, которое объединяет
эти два в химически эквивалентных количествах, мы можем вычислить, какое значение
неизвестно должно быть.
Другой
В образце обычно есть что-то неизвестное. Выполняя титрование, которое объединяет
эти два в химически эквивалентных количествах, мы можем вычислить, какое значение
неизвестно должно быть.
КИСЛОТЫ И ОСНОВАНИЯ:
Кислота Аррениуса — это вещество, вырабатывающее ионы водорода H + или H 3 O + в водном растворе.
HA (водн.) + H 2 O H 3 O + (водн.) + A- (водн.)
Основание Аррениуса — это вещество, вырабатывающее гидроксид-ионы ОН- в водном растворе.
MOH (водн.) + H 2 O OH- (водн.) + M + (водн.)
2 Присутствуют в количествах, которые точно будут реагировать друг с другом в соответствии с реакцией титрования. 3 Конечная точка титрования — это точка, в которой индикатор меняет цвет. Пробуем выбрать индикатор так
, изменение цвета совпадает с точкой эквивалентности.
Стр. 4 из 10 Эксперимент № 9
Поскольку HCl представляет собой одноосновную кислоту 4, а NaOH является одноосновным основанием, 5 стехиометрическое соотношение для этого реакция
1 моль HCl: 1 моль NaOH. Это означает, что в точке эквивалентности реакции титрования мы
могу сказать следующее.
Это означает, что в точке эквивалентности реакции титрования мы
могу сказать следующее.
В ТОЧКЕ ЭКВИВАЛЕНТНОСТИ:
(1) моль HCl, присутствующая изначально = моль NaOH, добавленная из бюретки
(2) Macid. Vacid = Mbase. Vbase
Уравнение (2) применяется, когда кислота и основание оба присутствуют в водном растворе.Если мы Зная молярность кислоты, мы можем найти молярность основания из данных титрования. По Точно так же, если мы знаем молярность основания, мы можем найти молярность кислоты по тот же процесс. Обратите внимание, что если титрование настроено, как показано в верхней части предыдущей страницы, объем кислоты будет взят из исходного объема, использованного при пробоподготовке, поэтому он должен быть тщательно измеряется. Объем NaOH определяется разницей между начальное и окончательное считывание бюретки.
Пример. 25,00 мл раствора NaOH неизвестной молярности титруют
стандарт 6 0,0988 М раствор. 37,50 мл раствора HCl требуется для достижения
конечная точка титрования. Какова молярность раствора NaOH?
Какова молярность раствора NaOH?
Решите, подставив данные титрования в уравнение (2) выше.
(0,0988 M) (37,50 мл) = MNaOH (25,00 мл)
MNaOH = (0,0988 M) (37,50 мл) = 0,148 M NaOH (25,00 мл)
ПРОЦЕДУРЫ
A) Приготовление и стандартизация раствора NaOH.
1) Перенесите гранулы в количестве, указанном вашим инструктором, чтобы получилось около 2 г NaOH в чистую колбу Флоренции емкостью 500 мл. Оставляйте бутыль с NaOH открытой только как до тех пор, пока это абсолютно необходимо, и обязательно закройте бутылку крышкой. Гранулы поглощают воду и углекислый газ из окружающей среды. Вы заметите, что гранулы в вашей колбе выглядят влажными на поверхности несколько раз. минут после того, как вы их отмерили.
4 Тот факт, что 1 моль HCl обеспечивает 1 моль ионов H +, делает HCl монопротоновой кислотой.5 Тот факт, что 1 моль NaOH обеспечивает 1 моль OH-, делает NaOH одноосновным основанием.
6 Стандартный раствор — это раствор, молярность которого известна с большой точностью.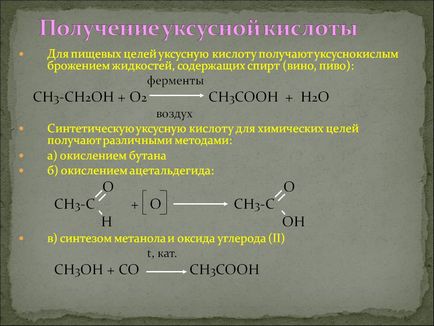 Выполнить расчет титрования
Выполнить расчет титрования
, мы должны предположить, что одна молярность точно известна, чтобы произвести расчет. Если это значение неточно, наши результаты будут быть далеко, как бы хороша ни была наша точность.
Кислотное титрование Страница 5 из 10
2) Наполните колбу Florence наполовину дистиллированной водой, взбалтывайте и перемешивайте, пока NaOH растворяется.Затем продолжайте доливать дистиллированную воду до низ шеи. Бутылку с пробкой, чтобы вы могли встряхнуть ее, когда нужно слить немного раствора NaOH.
* Если дать этому раствору отстояться, он разовьет заметный градиент плотности
, поскольку растворенный NaOH опускается в сторону дно. Через некоторое время вы сможете заметить отчетливую разница между концентрацией вверху и внизу колба.
3) Подготовьте бюретку для титрования.Чистая бюретка — промыть дистиллированной водой. Затем дважды промойте 5 мл раствора NaOH.
4) Установка для титрования (см. Справа). Заполните бюретку. Следите за пузырьками воздуха в наконечнике.
Справа). Заполните бюретку. Следите за пузырьками воздуха в наконечнике.
5) Налейте около 90 мл стандартной 0,100 M HCl в чистый, сухой 150-мл стакан, и используйте его для подготовки образцов. Запишите точную молярность стандартный HCl.
6) Очистите и ополосните 3 колбы Эрленмейера дистиллированной водой. Очистите и ополосните Пипетка для переноса 25,00 мл сначала дистиллированной водой, а затем двумя промывками по 5 мл стандартный раствор HCl.
7) Подготовьте 3 стандартных образца кислоты для титрования. Пипетка 25,00 мл стандарта 0,100 M HCl в каждую колбу Эрленмейера, а затем добавьте 2 или 3 капли индикатора фенолфталеина решение. Пометьте 3 образца A, B и C.
8) Запишите начальное показание бюретки. Поскольку калибровочные метки на бюретке составляют 0,1 мл
кроме того, теоретически мы можем считывать объем бюретки с погрешностью +0,01 мл. Тем не мение,
из-за чрезвычайно близкого расстояния между строками следует записывать объемы с шагом
из + 0. 05 мл. Помните также, что объем 0,05 мл — это примерно объем 1
падение.
05 мл. Помните также, что объем 0,05 мл — это примерно объем 1
падение.
Осторожно: NaOH очень едкий. Не прикасайтесь к гранулам NaOH. Ослабьте их
, постучав по бутылке и с помощью шпателя отделите гранулы в бутылке. Если вы придете При контакте с твердым NaOH немедленно вымойте одежду или кожу.
Осторожно: NaOH очень гигроскопичен. Это означает, что вода собирает воду из воздуха. Вы нельзя оставлять бутылку открытой более чем на несколько секунд, иначе гранулы намокнут и начнутся прилипание
Кислотно-основное титрование Страница 7 из 10
4) Титруйте каждый образец, как раньше, записывая начальный и конечный объемы NaOH. решение каждый раз.
* Это будет более медленное титрование, чем HCl. Уксусная кислота — слабая кислота, а соляная кислота
— сильная кислота. Слабые кислоты ионизируются и выделяют ионы H + намного медленнее. чем сильные кислоты.
C) РАСЧЕТ ТИТРАЦИИ.
В этом эксперименте ваши результаты будут оцениваться по точности и точности.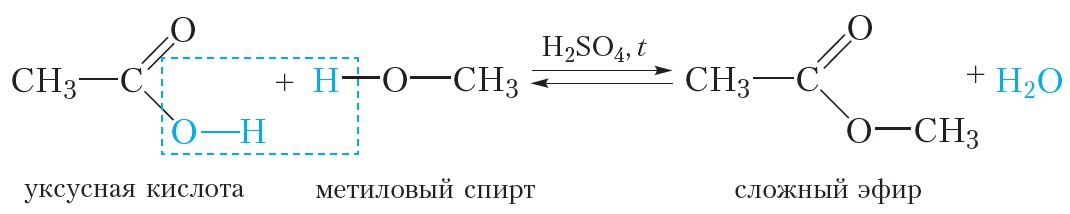 Пока ты не можешь
знать, точны ли ваши результаты или нет, вы можете и должны проверить свою точность
перед тем, как покинуть лабораторию, чтобы проверить, находится ли он в допустимых пределах.
Пока ты не можешь
знать, точны ли ваши результаты или нет, вы можете и должны проверить свою точность
перед тем, как покинуть лабораторию, чтобы проверить, находится ли он в допустимых пределах.
Требования к точности в Части A заключаются в том, что 2 из 3 титрований должны давать молярность NaOH. в пределах 1% друг от друга. Вам следует проработать свои три молярности, а затем посмотреть, разница любых двух из них составляет менее 1% от среднего значения этих двух.
% Среднее отклонение = | Молярность A — Молярность B | х 100% между образцами A и B Средняя молярность A и B
Если ваше наименьшее% среднее отклонение составляет не менее 1%, вы потеряете определенную сумму Точность в части А.
Требования к точности в Части B по существу такие же, как и в Части A, за исключением того, что здесь
молярности, которые вы вычисляете, относятся к уксусной кислоте в уксусе. Если ваш наименьший% среднего
отклонение не менее 1%, вы потеряете некоторую оценку точности по Части B.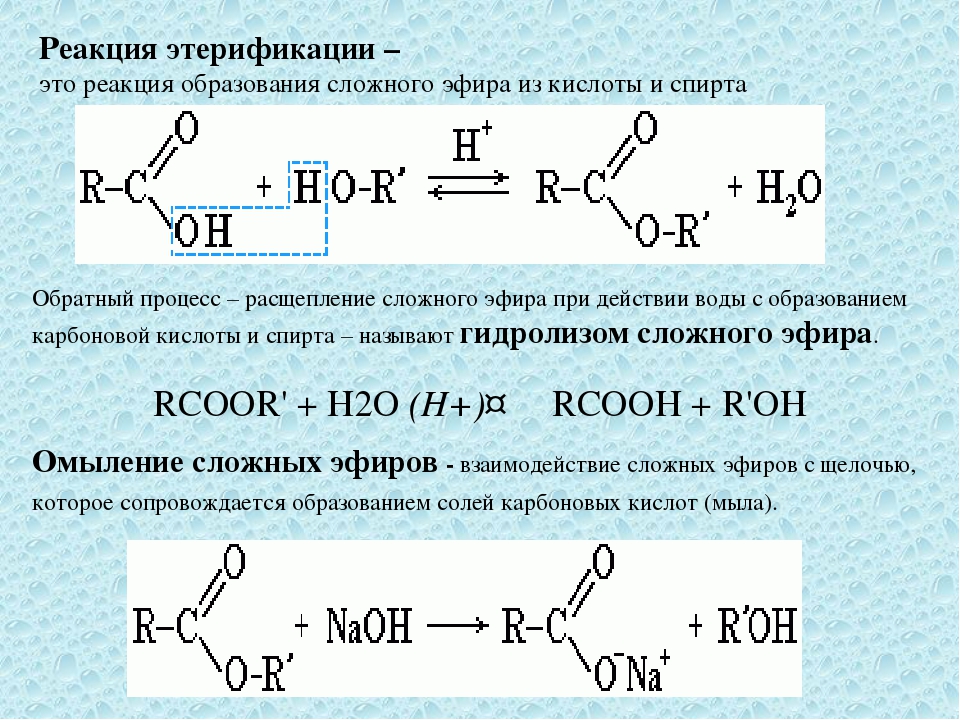
Если вы обнаружите, что вашей точности недостаточно для полного кредита, а у вас еще есть оставшееся время, возможно, вы захотите провести еще одно титрование, чтобы заменить худшее титрование.
Обратите внимание: когда вы записываете объем уксуса, использованного при титровании, в строке №12, вы должны есть 5.00 мл, а не 25,0 мл. Вся уксусная кислота, обнаруженная во время титрования, поступала из 5 мл раствора. уксус, и это объем, который следует использовать для расчета молярности уксусной кислоты (HC 2 H 3 O 2) в уксусе. Воду добавляли для облегчения процесса титрования. Не используется в расчете.
Стр. 8 из 10 Эксперимент № 9
Вам следует заранее (до прибытия в лабораторию) отвечать на вопросы, основанные на эта лаборатория. Вам будут заданы вопросы по концепциям, взятым из этой лабораторной работы, аналогичным перечисленным ниже. Дополнительные справочные материалы можно найти в вашем учебнике.
Вы должны быть в состоянии ответить на любой вопрос (аналогичный приведенному ниже) о перечисленных концепциях. ниже:
ниже:
1) Вы должны написать сбалансированное химическое уравнение для любой реакции нейтрализации.
Напишите реакцию нейтрализации фосфорной кислоты, H 3 PO 4 и калия. гидроксид, КОН.
Ответ: H 3 PO 4 (водн.) + 3KOH (водн.) 3H 2 O (l) + K 3 PO 4 (водн.)
2) Вы должны уметь рассчитать молярность раствора, исходя из массы (г) вещество и объем, в котором оно растворено.
Рассчитайте молярность раствора NaOH, содержащего 1.500 граммов NaOH в 375. мл раствора.
Ответ: [1,500 г NaOH (1 моль NaOH / 39,9971 г)] / 0,37500 л = 0,1000 M NaOH
3) Вы должны уметь использовать стехиометрию для соотнесения молей продукта с молями продукта. реагент
25,00 мл раствора HCl неизвестной концентрации титруют до фенолфталеина. конечная точка. Если использовали 21,30 мл 0,09550 М NaOH, какова молярность кислоты? решение?
Отв.: HCl (водн.) + NaOH (водн.) 3H 2 O (l) + NaCl (водн.), Моль кислоты = моль основания
21,30 мл (0,09550 ммоль NaOH / мл) (1 ммоль HCl / 1 ммоль NaOH) (1 / 25,00 мл) = 0,08137 М HCl
4) Вы должны уметь отвечать на вопросы процедуры, например:
Какого цвета индикатор фенолфталеина в кислом растворе?
Какого цвета индикатор фенолфталеина в щелочном растворе?
Какое изменение цвета вы ожидаете увидеть в конце титрования?
ПРЕДВАРИТЕЛЬНЫЕ ВОПРОСЫ
Стр. 10 из 10 Эксперимент № 9
10 из 10 Эксперимент № 9
Титрант NaOH в этом эксперименте был подготовлен примерно до 0.1 M, а затем был стандартизирован для определения его точной концентрации. Какие возможные причины могли быть для не просто взвешивание твердого NaOH, растворение до известного объема и расчет его молярность?
Двуокись углерода из воздуха растворяется в воде, образуя небольшое количество углекислоты, H 2 CO 3, и вода становится слегка кислой. Будет ли это способствовать титрованию объем в части А этого эксперимента слишком велик, слишком мал или не изменился? Вкратце объясните!
Было бы правильно использовать формулу, в которой написано Macid.Vacid = Mbase. Vbase при эквивалентности точка титрования между H 3 PO 4 и NaOH? Вкратце объясните!
Используйте указанную вами молярность для уксуса (среднее значение), чтобы рассчитать% по массе HC 2 H 3 O 2 в уксусе. Предположим, что плотность раствора составляет 1,036 г / мл.